안녕하세요, 이번엔 2023년 말에 전공수업에서 공부하고 리뷰 발표했던 논문을 다시 한번 정리해보려고 합니다.
논문 제목은 'PKM2 Drives Hepatocellular Carcinoma Progression by Inducing Immunosuppressive Microenvironment'로, 2020년에 개재된 논문이었습니다.
PKM2 Drives Hepatocellular Carcinoma Progression by Inducing Immunosuppressive Microenvironment - PMC
Abstract Background and Aims Pyruvate kinase M2 (PKM2) is an essential regulator of the Warburg effect, but its biological function promoting immune escape of hepatocellular carcinoma (HCC) is unclear.Methods GEPIA web tool and immunohistochemistry (IHC) a
pmc.ncbi.nlm.nih.gov
본 논문은 말 그대로, PKM2라는 효소가 면역 억제 환경을 유도함으로써 Hepatocellular Carcinoma(HCC)라 불리는 간세포암의 진행을 유도함을 입증하는 내용이 담겨 있었습니다.
먼저 연구배경부터 소개하겠습니다. Hepatocellular Carcinoma, 간 세포암은 암 중에서 세계에서 네 번째로 사망률이 높은 암 유형입니다. 간 암중에서는 거의 90%를 차지하는 암이라고 하는데요. 참고로 여기서 Carcinoma는 악성의 상피성 종양을 지칭하는 ‘암종’을 의미합니다. 이러한 악성(Malignant) 종양은 암세포가 빠르게 증식하며, 주변 조직을 침범하는 전이(metastasis)를 일으킬 가능성이 높은 종양이고, 양성 종양은 암세포가 아니라 전이가 되지 않기에 제거하면 치유할 수 있는 종양을 말합니다(종양 그 자체는 체내 세포가 과다하 발육된 상태 2)를 의미). 음성은 암 진단 결과 암세포나 암 관련 마커가 발견되지 않았음을 의미하죠. 간세포 암종은 악성 종양으로, 주변 조직으로 전이되어 간을 파괴해 우리의 생존을 위협할 수 있습니다. 이를 막기 위해 간세포암 치료에는 다중 키나아제 억제제, PD-1/PD-L1 blockade therapy 등이 활용되고 있다고 합니다.
다중 키나제 억제제의 대표적인 예로는 Lenvatinib과 Sorafenib이 있는데요. Lenvatinib은 티로신 키나제를 억제하여 암세포의 성장을 저해하는 항암제로 알려져 있습니다. 여기서 티로신 키나제는 '암세포의 성장과 생존에 중요한 신호 전달 경로에 관여하는 단백질'의 티로신 잔기에 인산기를 부여해 해당 단백질을 활성화시키는 역할을 하므로, Lenvatinb은 이 티로신 키나제의 기능을 억제함으로써 암세포의 무분별한 증식을 방지하고 종양의 성장을 억제합니다. 다음으로, Sorafenib은 암세포의 증식과 혈관신생(angiogenesis)을 억제하고, 암세포의 자멸사(apoptosis)를 촉진하는 역할을 하는 다중 키나제 억제제라고 합니다.

PD-1/PD-L1 blockade therapy는 종양 세포의 표면에서 발현하는 PD-L1이 T 세포의 PD-1에 결합하여 암세포가 T 세포의 면역 공격을 억제하는 기작이 이루어지지 않도록 하는 방법인데요. 구체적으로, PD-L1이 PD-1에 결합하지 못하도록 둘 중 하나 혹은 둘 모두의 수용체에 anti PD-L1 혹은 anti PD-1 항체를 결합시키는 방법입니다. 그럼으로써 T 세포가 면역 억제가 되지 않고 종양 세포를 제대로 죽이도록 유도하는 것이죠. 암세포가 면역세포의 공격을 억제시킬 수 있는 장치가 있다는 것 만으로도 놀랍긴 합니다.

그렇지만, 이러한 차단 요법도 환자 중 20% 미만의 환자에게만 효과적이라고 알려져 있습니다. 따라서 어떤 환자가 PD-1/PD-L1 blockade therapy에 효과적인지, 그리고 본 요법이 효과적이지 않은 사람에게는 치료 효과를 높이기 위해 어떤 부가적인 조치가 필요할지, 이해하려는 노력이 이어지고 있습니다. 본 연구에서는 HCC의 치료에 있어 두 개의 수용체 중 암세포의 PD-L1에 대한 blockade therapy를 진행할 때, PKM2가 치료 효과를 높이는 바이오 마커로 활용될 수 있음을 제시했습니다. 그렇다면 PKM2는 무엇일지 잠깐 설명하겠습니다.
PKM2는 피루브산 키나아제의 일종으로, 포스포엔올피루브산(PEP)과 ADP를 피루브산과 ATP로 전환하는 반응을 촉매하는 효소입니다. 이 과정은 해당과정에서 포도당을 피루브산으로 전환하는 일련의 단계 중 마지막 단계에 해당합니다. 그렇게 만들어진 피루브산은 이후 미토콘드리아로 이동하여 산화적 인산화를 통해 더 많은 ATP를 생산하는 데 사용되는데요. 물론 해당과정에서도 포도당 1개 당 ATP 2개가 생성되지만, 이는 2개를 소비하여 4개를 만들어내는 반응에 불과하며, 해당과정을 통해 만들어진 피루브산으로부터 진행되는 '산화적 인산화'로 생산되는 약 34개의 ATP에 비하면 훨씬 적은 양입니다. 또 다른 피루브산 키나제인 PKM1은 고촉매 활성을 나타내어 피루브산을 신속하게 미토콘드리아로 전달함으로써 산화적 인산화가 원활하게 이루어지도록 합니다.
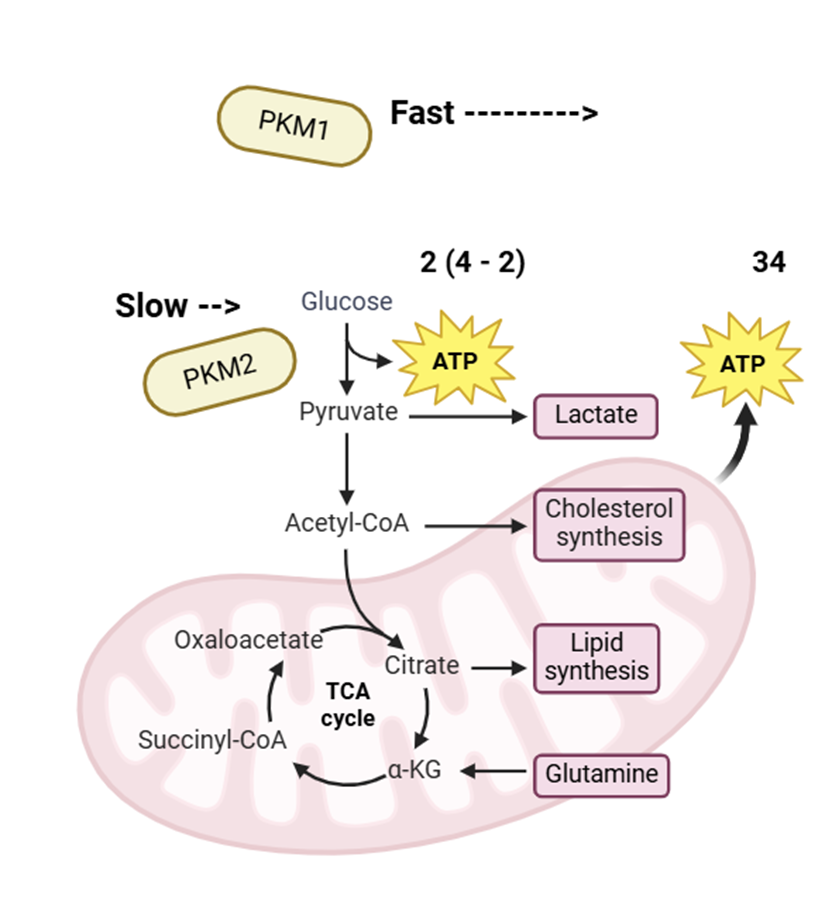
반면, PKM2는 저촉매 활성을 보여 해당과정을 통한 피루브산 생성 속도를 늦추죠. 결과적으로 PKM1 대신 PKM2가 작용하면 해당과정은 지속되지만, 생성된 피루브산이 미토콘드리아로 충분히 이동하지 못하고 세포질에 축적됩니다. 피루브산이 빠르게 생성되지 못하면, 세포질 내 피루브산 농도가 낮아서, 미토콘드리아 내로 피루브산을 이동하는 '미토콘드리아 피루브산 수송체(MPC)' 작동을 위한 농도 구배(gradient)를 형성하기 어려울 수 있기 때문입니다. 버스에 일정 인원 이상이 타야 수요에 맞춰 버스가 운행될 수 있는 것에 비유할 수 있겠습니다. 사람이 너무 없으면 기름값에서부터 적자가 날테니까요. 이는 에너지 낭비죠. 그런데 산화적 인산화로 많은 양의 ATP를 만들어내려면 미토콘드리아로 이동해야 하는데.. 결국 PKM2는 해당 세포의 대사 과정을 해당 과정에 의존하도록 하고, 하나의 포도당으로부터 적은 양의 ATP 밖에 만들어내지 못하게 합니다. 또한, 미토콘드리아로 이동하지 못하고 세포질 내 축적된 피루브산은 결국 젖산탈수소효소(LDH)에 의해 빠르게 젖산으로 전환되며, 젖산이 축적되면 해당 환경은 산성화됩니다.
PKM2의 이러한 특성은 암세포에게 매우 유리하게 작용합니다. 먼저 암세포는 산소가 충분해도 산화적 인산화를 거치지 않고, ‘유산소 해당작용(aerobic glycolysis)’만으로 ATP를 생성하는 이른바 Warburg 효과를 보입니다. 이는 암세포가 포도당을 과도하게 섭취해(주변 정상 세포의 포도당 섭취를 방해할 정도로) 해당과정에서 생산되는 상대적으로 적은 양의 ATP만으로도 충분한 에너지를 확보할 수 있을 뿐 아니라, 해당과정 중간 산물(intermediate)이 암세포의 빠른 성장·증식에 도움을 주기 때문으로 추측되고 있습니다. 이러한 맥락에서 해당과정의 속도를 조절해 에너지 대사를 해당과정에 의존하게 만드는, 그러면서 암세포 성장과 증식에 도움이 되는 중간체를 많이 만들어내도록 하는 PKM2는 암세포가 빠른 성장을 위해 필요한 물질을 지속적으로 공급받는 데 도움을 줍니다. 특히 피루브산이 젖산으로 전환되어 형성되는 산성 환경은 면역세포의 접근과 기능을 저해해 암세포 살해를 어렵게 만든다고 합니다. 심지어 PKM2는 혈관신생 유전자(빠르게 증식하는 암세포가 밥먹으려면 혈관도 빠르게 신생하며 영양분 보충해야 하기에), 지질 합성 유전자(빠르게 증식하는 만큼 세포막도 많이 필요하기에) 등 암세포 생존·증식에 관여하는 유전자 발현을 조절하는 전사인자나 히스톤 단백질의 활성을 조절하여 암세포에게 유리한 환경을 조성한다고 알려져 있습니다. 이를 Biorender에서 그림으로 나타내봤습니다. 유료 결제를 하긴 했는데, 되게 알찬 웹 툴인 것 같습니다.

그중에서도 PKM2는 산소 공급이 부족할 때 활성화되는 전사인자인 HIF-1α에 결합하여, HIF1α의 표적 유전자 전사를 촉진하는 것으로 알려져 있습니다.
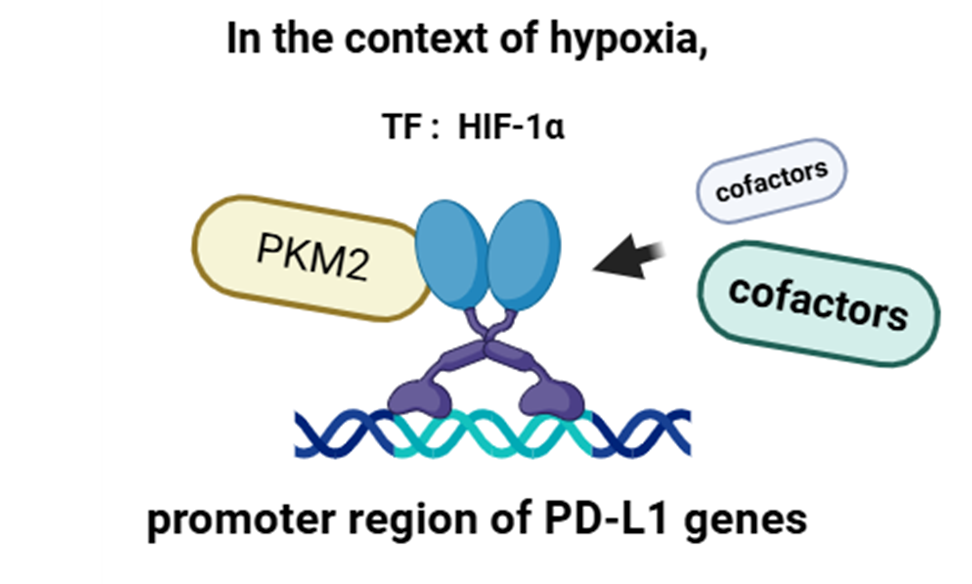
선행 연구에 따르면 암과 같은 저산소증(hypoxia) 환경에서의 PD-L1 발현 증가는 HIF-1α에 의존하며, 이 과정이 PKM2와도 관련이 있다고 보고되었다 1)고 합니다. 구체적으로, PKM2/HIF-1α 복합체가 여러 보조인자를 끌고와 PD-L1 유전자 발현을 촉진할 수 있다고 보고되었습니다. 앞서 말했듯, 암세포에서의 PD-L1 발현 증가는 암세포가 T 세포의 공격을 회피하도록 만들어 암세포 생존에 유리한 환경을 조성할 수 있습니다. 이에 따라 본 연구팀은 HHC에서 면역회피(immune escape)가 일어나는 기전에서 PKM2의 역할을 밝히기 위해, 해당 암 조건에서의 PKM2와 PD-L1 사이의 연관성에 대한 연구를 진행했습니다. 결론부터 잠깐 말하자면, PKM2와 PD-L1 사이의 정적인 상관관계가 나타난 것은 물론, PKM2가 높게 발현된 종양에 PD-L1 blockade therapy 적용 시 종양성장 억제 효과가 다른 조건에 비해 가장 크게 나타났는데요. 이는 PKM2가 HIF-1α와 함께 PD-L1 발현을 촉진함으로써, PD-L1 blockade의 타겟을 명확히 해주기 때문으로 추측할 수 있습니다.
본 연구의 디자인은 다음과 같습니다. 물론, 임의로 제가 간단히 나타낸 것이기에 다음과 같지 않을 수 있습니다. 정확한 건 논문을 참고하시길 바랍니다. 본 글은 단순히 제가 하루씩 쌓아가는 과정에 의욕을 불어넣고자 정리하는 것에 불과합니다.

먼저, 연구팀은 TCGA와 GTEx RNA 시퀀싱 데이터 기반으로 하는 GEPIA 웹 툴을 활용해서 HCC에서의 PKM2의 mRNA expression level을 확인하였습니다. 구체적으로, PKM2의 발현 수준에 따른 HCC 환자의 생존율, 그리고 병기별 PKM2 발현량을 비교했습니다. mRNA가 있다고 꼭 그 mRNA가 단백질로 발현되었으리라 보기 어렵습니다. 연구팀은 87명의 HCC 환자 시료로부터 TMA 블록을 제작한 뒤, IHC 염색을 통해 HHC에서의 PKM2의 protein level도 확인하였습니다.

다음으로 HCC cells에서의 PKM2의 특정 역할을 규명하기 위해, in vitro 조건에서 PKM2를 넉다운하거나 과발현 시켰을 때 HCC 세포의 proliferation 정도를 Cell proliferation assay와 Colony formation assay를 통해 확인하였습니다. 이외에도 HCC 세포의 migration 및 invasion 정도도 관련 assay를 통해 확인했는데 이에 대해선 뒤에서 보다 구체적으로 설명했습니다. PKM2의 mRNA와 단백질 발현 수준 모두 HCC에서 높아짐을 확인했는데, 왜 귀찮게 암세포의 증식 정도와 이동 정도까지 보냐 싶을 수 있지만, 귀찮은 걸 하길 좋아하는 과학자들이 보다 신뢰도 높은 과학적 결과를 발견해내는 듯 합니다. 본 연구팀은 in vitro를 넘어 in vivo 조건에서도 PKM2의 역할을 확인하기 위해 다양한 HCC 세포로부터 subcutaneous xenograft model을 만든 뒤, PKM2를 넉다운 시키거나 과발현시켰을 때의 종양 성장 정도를 비교해보았습니다.
이후엔 PKM2가 HCC의 악성 포텐셜을 조절하는 메커니즘을 조사하기 위해, GSEA를 통해 TCGA 데이터의 PKM2 high expression group에서 어떤 생물학적 과정과 관련된 유전자 세트가 높게 나타나는지 확인하였으며, in vivo 조건에서의 PKM2의 발현 정도에 따른 lactate production 정도도 Lactate detection assay를 통해 확인하였습니다. 이 PKM2가 암세포에서 어떤 역할을 하는지 궁금하지 않을 수 없으니까요. 또한, HCC 미세환경 내 면역반응에서의 PKM2의 역할을 조사하기 위해, GSEA를 사용해 PKM2-high group에서 풍부하게 나타나는 면역 반응 관련 signature 유전자 세트도 확인했습니다. 이후 GEPIA를 활용해 PKM2와 PD-L1 사이의 상관관계를 분석하였고, western blot과 IHC 염색을 통해 in vitro protein level에서도 그 둘이 상관성이 나타나는지 확인하였습니다.
추가로, Flow cytometric (FCM) analysis를 통해서도 PKM2와 PD-L1 사이의 상관성을 검증하였으며, in vitro 조건에서 T cell 유무, 그리고 PKM2 발현 정도에 따른 HCC 세포의 증식 정도도 비교했습니다. 스포를 먼저하자면, PKM2가 증가하면 PD-L1 발현이 증가하니까 T 세포의 면역 공격을 HCC 세포가 막아내겠구나 싶어서 그걸 입증하기 위해 요런 실험을 추가적으로 한 것입니다. 마지막으로, 쥐를 대상으로 in vivo 조건에서 PD-L1 blockade therapy를 적용했을 때, PKM2의 발현 정도에 따라 본 치료법에 따른 종양 성장 억제 효과가 어떻게 달라지는지도 확인하였습니다. 이 마지막 부분이 흥미로우면서도 추가적인 연구가 필요한 부분인 것 같습니다.
그렇다면 본 연구팀은 in vitro(체외)와 in vivo(체내) 조건에서 어떻게 PKM2를 과발현시키거나 발현을 억제한 것일까요? 먼저, PKM2 발현을 억제하는데 활용한 실험기법부터 소개하겠습니다.
연구팀이 PKM2의 발현 억제에 사용된 전략 중 하나는 ‘Sh-PKM2’를 활용하는 전략입니다. Sh-PKM2는 특정한 lentiviral short harpin RNA로, RNA interference라는 기작을 통해 PKM2를 만들기 위한 단백질 합성 과정이 일어나지 않도록 합니다. 그 절차에 대해 잠깐 짚고 넘어가겠습니다.
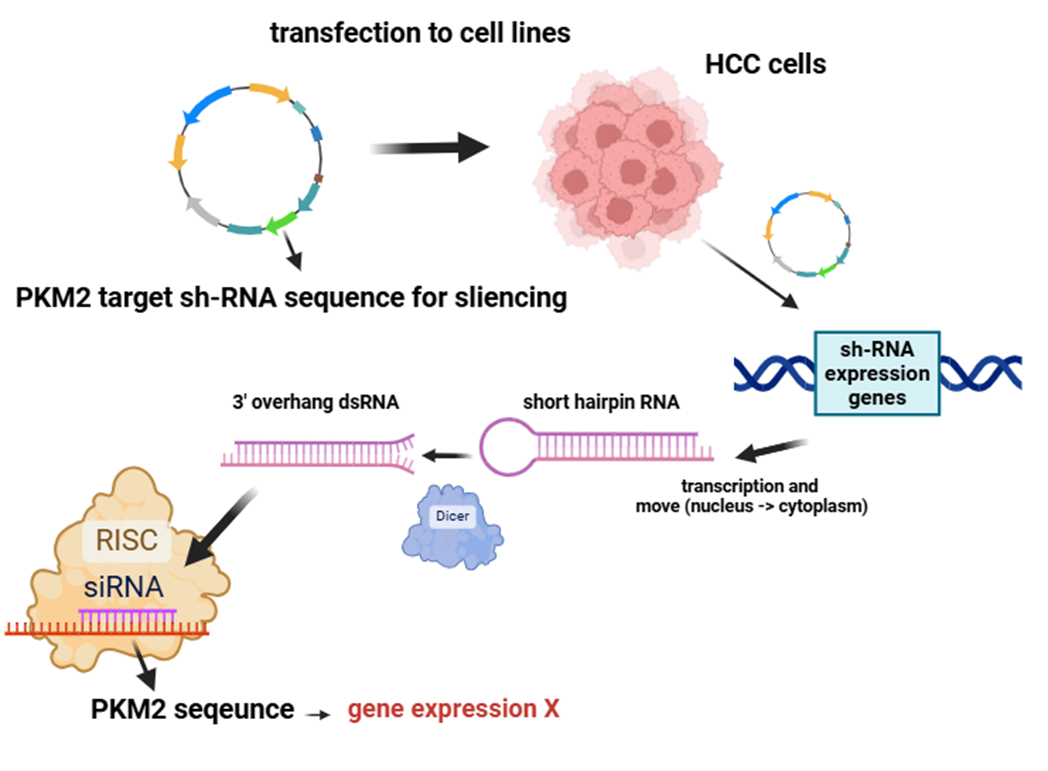
위의 이미지에서 보듯 먼저, PKM2 서열을 타깃으로 (억제하도록) 하는 short hairpin RNA를 만드는 DNA 서열을 렌티바이러스 벡터에 삽입합니다(참고로, 렌티바이러스 벡터는 분열중인 세포는 물론 비분열세포까지도 효율적으로 감염시킬 수 있는 등 유전물질 도입의 효율이 높아서 재조합 벡터로 흔히 사용된다고 합니다). 이후 이 렌티바이러스 벡터를 HCC 세포에 transfection시키면, 해당 세포의 DNA에 PKM2 타깃 shRNA 서열이 통합되고, 그럼으로써 shRNA 즉, short hair RNA들이 지속적으로 만들어지게 됩니다. 이 stem and loop 구조를 갖는 shRNA는 Dicer에 의해 가공되어 3' overhang을 갖는 double strand RNA 형태가 되고, 이후 그 중 표적 가닥 한 가닥이 siRNA로서 RISC complex를 통해 PKM2 유전자를 발현하는 mRNA 서열과 상보적으로 결합해, PKM2 유전자의 발현을 억제합니다. 보다 직접적으로 말하자면, 표적 서열인 PKM2 서열을 잘라냅니다. siRNA 말고 작년에 노벨상을 받은 miRNA는 표적 서열을 잘라내기도 하지만, siRNA와 달리 그냥 침묵을 시켜버리기도 하는데 이에 대한 내용은 길어질 듯해서 생략하겠습니다. 예전에 글로 정리한 적이 있긴 합니다.
[대학원 준비 7일차] RNA interference(RNAi)를 위한 siRNA(single interfering RNA), miRNA
오늘은 6일차에 정리한 RNA splicing에 이어, RNA interference에 대해 정리해보는 시간을 가져보겠습니다. [대학원 준비 6일차] mRNA splicing, Exonic splicing enhancers(ESEs), 그리고 self-splicing오늘은 전에 5' capping
tkmstudy.tistory.com
암튼 이것이 본 연구팀이 사용한 PKM2의 발현을 억제하기 위한 전략이었습니다. 물론, 추가적인 케이스로 PKM2 inhibitor를 사용해 PKM2의 기능을 직접적으로 억제하기도 했습니다.
PKM2의 overexpression을 위한 전략은 보다 쉽습니다. PKM2의 cDNA를 또 다른 렌티바이러스 벡터에 삽입한 뒤, 이 벡터의 PKM2 서열을 HCC 세포의 DNA에 통합시킵니다. 그로인해 PKM2 유전자가 많아지니 보다 많은 PKM2 단백질을 만들게 되는 것이죠.

그럼 이제 연구 결과를 하나씩 소개해보도록 하겠습니다. 본 연구팀은 앞서말했듯 먼저 GEPIA web tool을 활용해서 HCC와 nontumor liver tissue에서의 PKM2 mRNA 발현 수준을 비교했습니다.
GEPIA 웹 툴에 대해 잠깐 소개하고 하자면, 이는 TCGA와 Genotype-Tissue Expression (GTEx)에서 수집된 방대한 양의 RNA 시퀀싱 데이터를 기반으로 암 조직과 정상 조직 간의 특정 유전자의 발현 차이를 비교 분석할 수 있도록 설계된 툴입니다.
GEPIA (Gene Expression Profiling Interactive Analysis)
##### GEPIA2 2019 Release notes ##### The GEPIA server has been running for two years and processed ~280,000 analysis requests for ~110,000 users from 42 countries. We proudly present GEPIA2, an updated and enhanced version of GEPIA. Highlights: · Isoform
gepia.cancer-pku.cn
다시 말해, PKM2와 같은 특정 유전자가 암조직과 정상조직 각각에서 어느 정도로 발현되는지 RNA 시퀀싱을 통해 파악한 방대한 양의 데이터들을 토대로, 조건별 유전자 발현 수준을 비교할 수 있도록 한 것입니다. 본 연구에서 GEPIA 툴을 사용해 PKM2의 유전자 발현 수준을 비교해본 결과, HCC 환자에게서 정상조직보다, 그리고 HCC의 병기가 높아질수록 PKM2의 mRNA 발현 수준이 높게 나타났습니다. 또한, high PKM2 group에서 low PKM2 group보다 시간이 지남에 따라 생존율이 급격히 떨어지는 poor prognosis를 보였는데요. 물론, 80개월 이후부터는 high PKM2 group의 생존율이 low PKM2 group보다 높게 나타나긴 했습니다. 허나 High PKM2 group에서 상당수가 80개월 이전에 이미 사망했을 가능성이 크기에, 해당 영역의 표본 수가 적은 것은 물론, 그 시점에 살아남은 극소수 환자들은 다른 임상적으로 특이한 요인을 가질 수 있기에, 전체 위험도를 기준으로 판단하면, PKM2 high group이 poor prognosis를 보였다고 판단할 수 있겠습니다. 정확한 정보는 아래 논문 이미지를 참고하시길 바랍니다.
Figure - PMC
Copyright © 2020 Li, Wang, Shen, Zhang, Chen, Wang, Zhu, Xu, Hu, Wei, Zheng, Dong and Qin This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY). The use, distribution or reproduction in other forums
pmc.ncbi.nlm.nih.gov
다음으로 본 연구팀은 87명의 HCC 환자에서의 PKM2의 protein level을 Tissue microarray (TMA)에 대한 IHC staining을 통해 확인했습니다. 이를 위해 PKM2에 결합하는 1차 항체와 염색에 가장 많이 쓰이는 chromogen인 Diaminobenzidine (DAB)에 반응하는 HRP가 결합된 2차 항체를 사용했다고 하는데요. PKM2가 존재하면, 항원 항체 결합을 통해 DAB 기질이 horseradish peroxidase (HRP)와 반응해 dark brown reaction product를 생산합니다. 본 연구팀은 PKM2 단백질 수준 평가를 위해 염색이 된 전체 cell 중 positive staining cell의 비율을 기준으로 점수를 매겼습니다.

그리고 연구팀은 낮은 점수가 나온 score 0과 1을 low PKM2 group, 높은 점수가 나온 score 2와 3을 high PKM2 group으로 구분한 뒤 생존 곡선을 통해 그룹 별 환자의 생존율을 비교했는데요(score 4는 안 나왔나 봅니다). mRNA 수준에서 봤던 것처럼 protein level에서도 high PKM2 group에서 low PKM2 group보다 시간이 지남에 따라 생존율이 급격히 떨어지는 poor prognosis를 보였습니다. disease-free survival 즉, 치료 후 질병이 나타나지 않고 살아남은 사람의 비율 또한 high PKM2 그룹이 low PKM2 그룹보다 낮게 나타났습니다.
이후 연구팀은 Western blot을 통해 여러 human HCC cell line에서의 PKM2의 발현 수준을 확인했는데요. 결과적으로, 다른 cell line에 비해 MHCC97-H와 HCC-LM3 등 높은 전이 잠재력, high metastasis potential을 가진 HCC cell line에서 PKM2의 높은 발현이 나타났습니다.
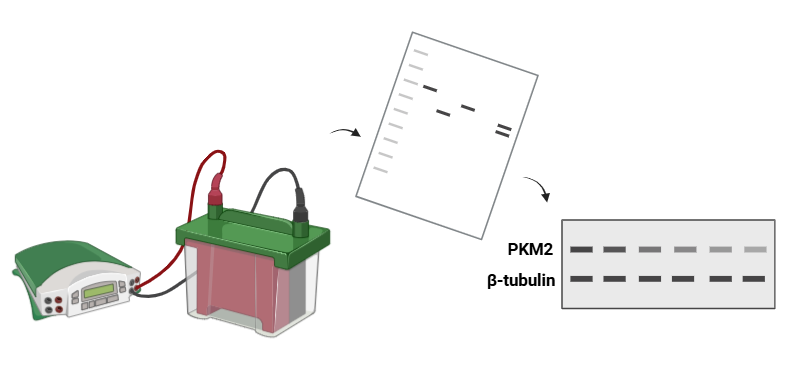
참고로 western blot은 세포에서 전체 단백질을 동정한 뒤, SDS-PAGES라는 전기영동을 통해 단백질의 아미노산 서열에 따른 '전하'와 서열의 길이에 따른 '크기'에 따라 단백질들을 분리한 뒤, anti-PKM2라는 PKM2 단백질에 붙는 항체, 그리고 그에 대한 2차 항체(신호 증폭이 가능한 민감도 높은 간접 기법)를 통해 PKM2의 위치를 파악한 뒤, 그 단백질 밴드의 수준을 광학 기법을 통해 확인하는 기법입니다. western blot에서 사용되는 β-tubulin은 흔히 하우스키핑 단백질(housekeeping protein)로 사용되는데요. 이 단백질들은 세포에서 상대적으로 안정적이고 균일하게 발현되기에 각 셀라인을 동일한 양의 단백질로 로딩했는지 확인하고, PKM2라는 목표 단백질의 상대적 발현량을 비교할 수 있게 한다고 합니다.
다음으로 높은 전이(high metastasis)를 갖는 PKM2가 고발현된 HCC cell line인 MHCC97-H 세포에 대해 앞서 말한 Sh-PKM2를 사용해서 PKM를 넉다운 시키거나, PKM2 inhibitor로 PKM2의 기능을 직접적으로 억제시켜보았습니다. PKM2가 고발현된 MHCC97-H 세포를 사용한 이유는 PKM2 억제로 인한 PKM2 발현량의 뚜렷한 차이가 HCC 세포의 증식 정도 차이로 이어지는지 보다 분명하게 확인하기 위함이라고 볼 수 있겠습니다. 확인 결과, 다음과 같이 PKM2를 넉다운하거나 억제한 조건에서 HCC 세포의 증식 능력이 상당히 저해됨을 확인할 수 있었습니다.
추가적으로, 각 조건에 대해 clone formation assay와, transwell을 사용한 migration and invasion assay를 진행했는데요. 결과적으로, Sh-PKM2 조건과 PKM2 inhibitor 투입 조건에서 HCC 세포의 clone formation과 migriation 및 invasion 능력이 저해됨이 확인되었습니다.

참고로, Migration 및 Invasion assay는 아주 작은 기공을 가진 폴리카보네이트 막으로 상·하부가 분리된 Transwell 챔버를 사용하는데요. 상부 챔버에 세포를 주입한 뒤 일정 시간 후 막을 통과한 세포를 염색하여 Migration 및 Invasion 능력을 정량적으로 평가합니다. 이때, Migration 정도를 확인하는 케이스에선 상부 챔버에 Martigel 없이 진행해 순수 이동 능력을 측정하고, Invasion 정도를 확인하는 케이스에선 막을 Matrigel 등으로 코팅하여 ECM 침윤(전이) 능력을 확인한다고 하네요. 즉, 본 방법은 상부 챔버에 세포를 주입하고 일정 시간 배양한 뒤, 막을 통과한 세포를 염색하여 현미경으로 Migation과 Invasion 정도를 정량적으로 관찰 및 계산하는 방식으로 진행됩니다.
다음으로 연구팀은 앞서 설명했듯 플라스미드를 이용해 유도한 PKM2 up-regulation 조건에서의 HCC cell의 proliferation, 그리고 migration, invasion 정도를 확인했는데요. 이번엔 HCC cell line 중 Huh7 cells를 이용해 Overexpresson 즉, OE-PKM2 조건을 유도하였는데요. Huh7 cell은 본래 낮은 PKM2 level을 갖기에, OE-PKM2의 도입에 따른 차이를 분명하게 확인하기 위해 사용한 것으로 추측됩니다. 그 결과 proliferation, migation, invasion 모두 OE-PKM2 조건에서 다른 조건에 비해 높게 나타났습니다.
Figure - PMC
Copyright © 2020 Li, Wang, Shen, Zhang, Chen, Wang, Zhu, Xu, Hu, Wei, Zheng, Dong and Qin This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY). The use, distribution or reproduction in other forums
pmc.ncbi.nlm.nih.gov
참고로, 대조군으로 사용된 'Huh7-EV'에서 EV는 Overexpression vector이자 빈 벡터를 의미하며 벡터 자체 혹은 벡터 도입 과정, 항생제 내성 유전자 삽입 등이 세포에 미치는 비특이적인 영향을 결과 해석에 배제하고 OE-PKM2로 인한 효과만을 정확하게 비교하기 위한 대조군으로 볼 수 있겠습니다. 생물학 연구 설계에서 무엇보다 중요한 것은 확인하고자 하는 연구 가설에 영향을 미치는, 실험군과 대조군에 작용하는 교란요인들을 통제하는 것이니까요. 종합적으로, in vitro 조건에서 PKM2의 발현을 억제했을 땐 proliferation과 migration 및 invasion 정도가 낮아지고, 발현을 높였을 땐 그 정도가 높아졌습니다. 그렇다면 PKM2가 HCC에서 어떤 작용을 하길래 HCC의 전이 능력을 높이는 건지 궁금해집니다.
이번엔 in vivo 모델에서의 PKM2 역할을 검증하기 위해 연구팀은 다양한 HCC 세포를 사용하여 subcutaneous xenograft model을 만들었습니다.
해당 쥐에 Sh-PKM2, 즉, 앞서 설명한 방식으로 렌티바이러스벡터를 주입해 PKM2를 넉다운한 결과 대조군에 비해 종양의 크기 즉, 종양의 성장이 억제되는 효과가 나타났습니다. 여기서 대조군으로 사용된 ‘Scr’은 Sh-control로 EV처럼 벡터 자체나 벡터 도입과정에서의 차이에 따른 영향을 배제하기 위한 벡터 대조군이라 보면 되겠습니다. 반면, Huh7 cell line에 대한 PKM2 overexpression 조건에선 종양의 크기가 대조군에 비해 크게 나타났습니다. 다시 말해, in vitro에서와 같은 결과(PKM2가 종양 성장에 주요 역할을 하는구나)가 in vivo에서 나타났음을 확인했습니다.
이에 더해, 연구팀은 xenografts tumors에서 PKM2와 Ki67 단백질에 대해 IHC staining을 진행했는데요. 참고로, Ki67 단백질은 수십년 간 인간 종양 세포의 증식 마커로 널리 사용되어온 단백질로, 세포 주기의 모든 활성 단계 동안 발현되지만 휴지 상태의 세포에선 발현되지 않는다고 합니다. 이러한 특징 덕분에 Ki67은 세포 집단의 성장 분율을 평가하는 활용할 수 있는 마커로 활용될 수 있으며, Ki67이 높다는 것은 그 조직이나 세포가 활발하게 분열중이라는 것을 의미합니다. 이러한 활발한 증식은 암세포의 주요 특징이죠. 물론 암세포말고도 다른 세포들(ex. 모낭 세포 등)도 활발한 증식을 특징으로 합니다. 결과적으로 Ki67 발현정도를 기반으로 확인했을 때 in vivo 조건에서 PKM2를 넉다운했을 때 MHCC97-H tumors의 증식이 억제되는 반면, PKM2의 overexpression은 Huh7 tumors의 증식을 촉진함을 확인했습니다. 이는 PKM2 발현이 HCC의 tumor growth와 metastasis를 촉진할 수 있음을 시사합니다. 풀어서 말하자면, HCC 암세포가 PKM2의 도움으로 보다 활발히 성장하고, 원발부위에서 혈관이나 림프관을 통해 이동해 다른 장기나 조직에 자리잡고 증식하는 전이가 활발하게 이루어질 수 있음을 의미합니다.
이후 연구팀은 HCC의 악성 잠재력을 조절하는 PKM2의 메커니즘을 규명하기 위해 TCGA data를 활용한 GSEA(Gene Set Enrichment Analysis)를 진행했습니다. 그 결과, PKM2 high expression group에서 cell cycle, G2/M checkpoint, glycolysis-glucogenesis에 관여하는 유전자들이 높게 나타났는데요. 연구 기법에 대해 보다 구체적으로 설명하자면, GSEA에선 TCGA 환자 샘플들을 PKM2 발현이 높은 그룹과 낮은 그룹으로 나누고, 각 유전자들의 발현량 변화를 이용해 전체 유전자를 하나의 리스트로 순위화했습니다. 즉, PKM2 발현과의 상관관계 등을 기준으로 해당 유전자 세트의 유전자들을 내림차순으로 정렬했습니다. GSEA 이미지에서 각 검정색 바코드는 유전자들을 의미하고, 녹색 그래프는 바코드가 어디서 클러스터를 이루는지 보여줍니다. 자세한 건 아래 논문 이미지를 참고하시길 바랍니다.
Figure - PMC
Copyright © 2020 Li, Wang, Shen, Zhang, Chen, Wang, Zhu, Xu, Hu, Wei, Zheng, Dong and Qin This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY). The use, distribution or reproduction in other forums
pmc.ncbi.nlm.nih.gov
보시면 Cell Cycle 유전자 세트의 경우, PKM2와 높은 상관관계를 보이는 유전자들이 클러스터를 이룸을 확인할 수 있으며, 다른 두 케이스도 마찬가지의 결과를 나타냈습니다. 물론, glycolysis /gluconeogenesis 유전자 세트의 경우 PKM2와 negatively correlate된 일부의 유전자가 클러스터를 이루긴 했지만, 이는 해당 유전자 세트가 해당작용 관련 효소는 물론, 해당과정의 역과정인 즉, 피루브산으로부터 포도당을 만드는 gluconeogenesis(포도당 신생) 관련 효소들이 같은 세트로 묶여 있기에 일부 효소들이 실제 PKM2 발현이 높을 때 억제되거나 방향성이 반대로 나타날 수 있기 때문으로 볼 수 있겠습니다. 물론 논문에 적힌 내용이 아니라 당시 저희 발표에서 몇몇 자료들을 보며 했던(뭘봤는진 기억이 아니지만) 추측, 그리고 챗GPT의 추측에 불과하기에 그렇지 않을 수 있습니다. 그렇지만 중요한 것은 GSEA의 본질은 유전자 세트 단위의 집단적 경향을 보는 것으로, 일부 유전자가 반대 방향으로 움직인다 해도 세트 단위로 PKM2 high 그룹에서 enrich한 양상이 확인되었기에 glycolysis/gluconeogenesis 유전자 세트의 발현 양상 또한 PKM2 발현이 높은 군에서 활성화되는 경향이 있다고 볼 수 있습니다.
연구팀은 HCC에서의 PKM2 변화에 의해 유도 되는 metabolic shift를 검증하기 위해, PKM2 발현 정도에 따른 케이스를 구분한 뒤, qRT-PCR을 사용해서 조건별 glucose metabolism에 관여하는 대사 효소들의 발현을 검출했습니다. 여기서 qRT-PCR은 in vivo HCC 세포에서 추출한 mRNA를 분리한 뒤, 대사효소 유전자에 특이적인 프라이머 세트를 사용하여 역전사 과정을 통해 cDNA를 합성하고 이를 증폭함으로써, 특정 효소와 관련된 mRNA 발현 수준을 상대적으로 비교할 수 있는 기법으로 볼 수 있겠습니다.
결과적으로 aerobic glycolysis에 관여하는 대표적인 대사 효소들은 PKM2를 넉다운시킨 Sh-PKM2 MHCC 97-H cells(HCC cell line)에서 상당히 감소됨을 확인할 수 있었습니다. 또한, PKM2를 과발현시킨 OE-PKM2조건에서는 EV 대조군에 비해 Aerobic glycolysis-related enzymes의 mRNA expression level이 높게 나타남을 확인할 수 있었습니다. 이외에도 연구팀은 Lactate detection assay를 통해 in vivo HCC 세포에서 PKM2의 발현 정도에 따른 lactate production 정도도 확인했는데요. 앞서 말했듯 Warburg effect를 나타내는 암 세포에서 PKM2 발현이 높아지면 이론적으로 젖산 축적이 늘어나게 될테니까요.
그 결과 PKM2를 넉다운 했을 때는 HCC cell의 lactate production이 억제되고, PKM2를 과발현시켰을 땐 HCC cell의 lactate production이 향상되어 나타났습니다. 이는 PKM2에 의해 해당과정의 속도가 느려져 세포질 내 축적되게 된 피루브산이 젖산으로 전환됨을 입증하는 결과로 볼 수 있겠습니다. 종합적으로 본 결과는 PKM2가 glucose metabolism 조절(metabolic reprogramming)을 통해 HCC의 progression을 촉진할 수 있음을 시사합니다.
다음으로 HCC에 대한 면역반응에서 PKM2의 역할을 탐구하기 위해, 본 연구팀은 또 다시 GSEA를 사용해 PKM2와 상관관계가 높은 면역 관련 유전자 세트를 확인했습니다. 그 결과 PKM2 low group보다 PKM2 high group에서 유의하게 나타난 시그니쳐는 lymphocyte migration, lymphocyte mediated immunity, 그리고 T cell migration이었습니다. 이는 PKM2가 T cell과 같은 림프구들의 이동에 관여할 수 있음을 암시하는 결과로 볼 수 있습니다. 앞서 PKM2 고발현 조건일 때 HCC 세포의 migration 및 invasion 정도가 높음을 확인했었는데, PKM2가 암세포는 물론 면역세포의 이동성도 높일 수 있군요. 마치 PKM2가 경찰과 도둑의 치열한 경주를 촉진하는 느낌입니다.
이에 더해, 본 연구팀은 GEPIA web tool을 이용해 HCC specimens에서 PKM2 level과 T 세포의 대표적인 마커인 CD45, CD4, CD8 level 사이의 상관관계를 분석하였습니다. 그 결과, PKM2와 세 가지 케이스의 T 세포 간 뚜렷한 상관관계가 모두 나타났습니다. 사실 앞선 이론 설명에서 PKM2로 인한 젖산 축적으로 만들어지는 산성 환경이 면역 세포가 그 환경으로 들어오기 어렵게 한다고 했는데, HCC 조건에서 T 세포의 증가 및 이동성 증가가 PKM2와 유의한 상관성을 보이니 신기하기도 합니다. 이론적 환경과 달리 실제 환경은 여러 요인이 복합적으로 작용하는 만큼 그에 대한 해석을 몇 가지 단서로만 하는 건 참 어려운 것 같습니다.
그리고나서 연구팀은 KEGG enrichment analysis를 통해 서로 다른 PKM2 level을 가진 HCC 조건 사이에서 높게 발현되는 서로 다른 immune-related genes를 파악했습니다. 구체적으로, 높은 PKM2 level을 가진 tumor에선 CD274(PD-L1), CTLA4, LAG3와 같은 immune inhibitory factor 뿐만 아니라 TNF와 IL-6 같은 염증성 사이토카인, CXCL1과 CSF1 같은 케모카인도 높은 수준으로 나타났습니다. 추가로, 높은 PKM2 level을 가진 HCC 조건에서 증가된 CD8 T cell, Treg cells, M2 macrophage와 감소된 M1 macrophage가 나타났습니다.

여기서 CD8 T cell은 종양세포를 죽이는 킬러 세포, Treg cell은 항염증반응에 관여하는 세포, M2 macrophage는 면역 억제와 같은 종양 미세환경 형성에 관여하는 세포 상태, M1 macrophage는 염증 반응과 같은 항종양 작용에 관여하는 세포 상태로 볼 수 있습니다. 알면 알수록 헷갈리는게 면역인 듯 합니다. PKM2 level이 높아지면 HCC 환경에서 염증성 사이토카인이 분비되면서, 면역 억제 인자들도 분비되고, 항염증성 세포들도 증가한다니 놀랍습니다. 종합적으로 본 결과는 높은 PKM2 발현이 inflammatory milieu를 유도하는 것은 물론, HCC progression을 지지하는 면역억제 미세환경을 만들 수 있음을 시사한다고 논문 저자는 말합니다.
다음으로 본 연구팀은 GEPIA를 활용해 HCC에서 PKM2와 PD-L1이 밀접한 상관관계를 나타냄을 확인했습니다. 본 상관관계는 western blot을 활용한 여러 HCC cell line에서의 protein level 확인, 그리고 TMA에서의 IHC 염색을 통한 확인을 통해서도 검증하였습니다.
보다 명확하게 본 상관관계를 규명하기 위해, 본 연구팀은 PKM2 expression을 조정한 후에 HCC cell에서의 PD-L1 level을 확인했습니다. 그 결과, PD-L1의 mRNA와 protein level 모두 PKM2를 Sh-PKM2로 넉다운했을 때 감소했고, PKM2를 과발현시킨 OE-PKM2에선 증가했습니다. 또한, Flow cytometric (FCM) 분석을 통해 PKM2를 넉다운하거나 inhibitor를 처리했을 때의 PD-L1의 발현 감소, 그리고 PKM2 과발현 조건에서의 PD-L1 발현 증가도 확인했습니다. 역시 결과의 신뢰도를 확보하기 위해선 동일한 관계에 대해 여러 기법들, 그리고 여러 분자 수준에서 확인하는 것이 중요한가 봅니다. 그리고 특정 조건에서 무언가의 역할을 확인할 때 특정 조건에서 무언가를 없애보는 전략은 단순하면서도 매우 효과적인 전략인 것 같습니다. 참고로, FCM 분석은 특정 항원을 발현하는 살아 있는 세포의 수를 세는데 사용할 수 있는 방법으로, 본 연구에선 PKM2의 발현 수준에 따른 PD-L1의 발현 수준을 정량적으로 확인하는 데 활용했다고 볼 수 있겠습니다. Flow cytometer(유세포분석기)로 특정 항원을 발현하는 세포의 양을 정량적으로 확인하는 것을 넘어, 이왕 분리한 거 그런 특징을 가진 세포를 분리해 사용할 수 있도록 하는 것은 ‘FACs(Fluorescence Activated Cell Sorting)’입니다. RNA-seq에 있어서 FACs로 분리한 특정한 특징을 가진 세포를 bulk RNA-seq으로 해당 세포 유형의 전사체적 특징을 분석하는 그런 케이스도 본 것 같습니다.

다음으로 본 연구팀은 HCC cell line에 CD8+ T cell을 공배양하는 T cell cytotoxicity assay를 진행했습니다. 본 기법에선 TCR 복합체 중 하나인 CD3 분자를 인식하여, T 세포를 활성화하는데 필수적인 시그널을 제공하는 anti-CD3 antibody를 HCC cell line(+ CD8 T cell)에 주입한다고 하는데요. 그렇게 HCC cell line인 Hepa1-6 cell에서 T cell을 주입한 조건과 주입하지 않은 조건에서 PKM2의 발현 정도에 따른 생존한 종양 세포의 양을 크리스탈 바이올렛으로 염색해 확인했습니다.
Figure - PMC
Copyright © 2020 Li, Wang, Shen, Zhang, Chen, Wang, Zhu, Xu, Hu, Wei, Zheng, Dong and Qin This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY). The use, distribution or reproduction in other forums
pmc.ncbi.nlm.nih.gov
그 결과 위의 이미지에서 보듯, PKM2를 넉다운 시켰을 땐 HCC 세포가 CD8 T cell에 컨트롤보다 더 민감하게 반응한 반면, PKM2를 과발현시켰을 때 CD8 T cell의 세포독성(암세포 죽이는 기능)에 대한 저항성이 컨트롤에 비해 더 높게 나타남을 확인하였습니다. 이는 PKM2의 발현 증가가 PD-L1 발현 증가를 유도해 T 세포의 면역 공격을 억제함으로써 암세포의 생존을 유리하게 할 수 있음을 혹은 그 역의 관계가 가능함을 입증하는 결과로 볼 수 있겠습니다. 다시 말해, HCC에서 PKM2는 PD-L1 발현 및 면역 회피와 밀접한 상관관계가 있으며, PKM2가 PD-L1 antibody treatment에 대한 반응에 있어 바이오마커로 역할을 할 수 있음을 시사합니다. 그렇다면 PKM2가 HCC cell line에 T 세포의 증가와 염증성 사이토카인 분비를 통한 염증 환경을 유도한다고 해도 PD-L1에 의한 면역 공격 억제 효과가 더 크니 PKM2에 의한 T 세포 증가가 종양 성장 억제에 큰 영향을 주지 못하는 것이겠군요.
마지막으로 연구팀은 PD-L1 blockade가 PKM2 level에 미치는 효과를 파악하기 위해, in vivo 조건에서 PKM2 발현 정도에 따른 종양 크기를 비교해보았습니다. 그 결과, PKM2를 넉다운 시키거나 aPD-L1 therapy( PD-L1 blockade)를 적용했을 때 대조군에 비해 in vivo tumor growth가 상당히 억제될 수 있음을 확인했습니다. 또한 PKM2를 과발현시켰을 때 aPD-L1을 적용했을 때 종양 크기도 비교해봤는데요. PKM2의 과발현이 종양 성장을 촉진하고, aPD-L1이 종양 성장을 억제하는 효과가 있는 것은 자명했지만, 흥미로운 것은 PKM2를 과발현시켰을 때 aPD-L1의 종양 성장 억제효과를 상당히 높일 수 있다는 점이었습니다.

이외에도 연구팀은 FCM 분석을 통해 aPD-L1 therapy에 의해 유도된 CD8 T cell의 IFN-γ secretion 증가가 OE-PKM2 그룹에서 OE-vector 그룹보다 상당하게 나타났습니다. 즉, HCC에서 PKM2 증가가 aPD-L1를 통한 CD8+ T cell의 IFN-γ secretion 유도가 보다 효과적으로 이루어질 수 있게 돕는다고 볼 수 있겠습니다. 종합적으로, 본 결과는 PKM2가 PD-L1 expression을 촉진하고, PD-L1 blockade therapy에 대한 HCC의 반응을 향상시킬 수 있음을 시사합니다.
결론입니다. 본 연구에서는 PKM2가 in silico, in vitro, in vivo 실험을 통해 PKM2가 면역억제 미세환경(immunosuppressive microenviroment) 유도와 PD-L1 up-regulation을 통해 HCC progression을 유도할 수 있음을 밝혔습니다. 또한, PKM2의 과발현은 HCC mice model에서 IFN-γ positive CD8 T cells의 면역 공격 기능을 향상시키는 PD-L1 blockade therapy에 민감하게 함을 보여주었습니다. PD-L1의 발현은 이질성이 높다고 합니다 1). 이에 PKM2의 높은 발현으로 PD-L1의 발현을 높이는 것이 치료 타깃을 명확히 하여 HCC에 대한 PD-L1 blockade therapy에 도움이 되는 것으로 추측이 됩니다. 무엇보다 PKM2는 앞선 결과에서 봤듯이 T 세포를 종양 미세환경으로 불러오는데도 역할을 할 수 있으니까요.
물론, 'PKM2 고발현에 의한 PD-L1 발현 증가'와 'PKM 고발현에 의한 PD-L1 blockade therapy의 효험 증가' 사이에 간극을 해결하기 위해선 추가적인 후속연구가 필요할 것 같습니다. 단순히, PD-L1의 발현이 치료 타깃을 명확히 하여 aPD-L1 치료법의 종양 성장 억제 효과를 높이는 것이 아닌, PKM2의 대사 재프로그래밍과 같은 다른 기작이 aPD-L1 치료법의 효험을 높이는 것일 수도 있을테니까요.

이것으로 논문 정리를 마치며, 자세하고 정확한 내용은 본 논문을 참고하시길 바랍니다. 감사합니다!

참고자료
1) Li TE, Wang S, Shen XT, Zhang Z, Chen M, Wang H, Zhu Y, Xu D, Hu BY, Wei R, Zheng Y, Dong QZ, Qin LX. PKM2 Drives Hepatocellular Carcinoma Progression by Inducing Immunosuppressive Microenvironment. Front Immunol. 2020 Oct 20
2) 종양, 두산백과 디비피아, URL : https://terms.naver.com/entry.naver?docId=1142526&cid=40942&categoryId=32774
'생물정보학(바이오인포매틱스)' 카테고리의 다른 글
| [44일차] 단일세포 전사체 분석 기술 개요 및 프로세스 정리 01 :: sequencing library 준비 및 구축, illumina sequencing (0) | 2025.03.26 |
|---|---|
| [43일차] 생물정보학 입문 책 정리 ch.02 :: 유전학에서 게놈까지 (2) | 2025.03.23 |
| [41일차] 생물정보학 입문 책 정리 Ch. 01 :: 서론 (0) | 2025.03.19 |
| [40일차] 프로그래밍 & 수학 책 정리 02 : 딥러닝을 위한 수학 (0) | 2025.03.12 |
| [39일차] 프로그래밍 & 수학 책 정리 01 : 딥러닝을 위한 수학 (0) | 2025.03.11 |



