안녕하세요, 오늘은 장내미생물과 숙주 면역계 간의 상호작용 양상 및 분석 툴에 대해 다룬 자료 및 논문들의 내용을 정리해보고자 하는데요. 내용이 길어질 것 같아 몇 가지 주제로 나눠 시리즈로 작성해보고자 합니다.
논문을 주로 참고하긴 했지만 장내미생물과 숙주 면역계 간의 상호작용은 굉장히 복잡하고 아직 명확히 밝혀지지 않은 부분이 많은 듯 합니다. 그만큼 관련 내용을 이해함에 있어 제 배경지식과 경험의 한계가 있기에 오류가 많이 있을 수 있다는 점 양해 부탁드립니다. 다음과 같은 순서로 정리해보고자 합니다.
1. 개요, 장내 미생물와 숙주 면역계 간의 상호작용에 대하여 (+ 항생제의 위험성)
2. 질병과 장내미생물 : 당뇨병, 감염 및 염증성 질환, 암, 자가면역질환, 만성신장질환, 뇌질환
3. 장내미생물과 숙주 면역 간의 상호작용 분석 툴 동향 : 멀티오믹스 통합으로
4. 미생물-기반 치료제 : 프로바이오틱스 및 프리바이오틱스, FMT(분변 미생물 이식), 미생물 공학 기술
1. 개요, 장내 미생물은 숙주 면역계 간의 상호작용에 대하여

미생물이란 동물과 식물을 제외한 바이러스, 세균, 효모, 곰팡이, 버섯, 미세조류, 원생생물 등의 모든 생물0)을 말하는데요. 이러한 미생물은 크기가 너무 작아서 눈에 보이지 않을 뿐 우리 주변 어디든 존재합니다. 한 책1)에서는 "이 지구에서 다른 모든 것을 제외하고 남은 미생물만 연결하더라도 지구의 형태는 그대로 유지될 것이다"라고 표현할 정도이죠.
인간의 몸에도 미생물이 곳곳에 존재합니다. 보통 미생물은 외부 환경에 노출되어 미생물과의 접촉이 빈번한 '피부'나 '점막 부위'에 자리를 잡으면서 군집을 형성하는데요. 군집을 형성하는 이유는 "미생물은 크기가 작고 보유한 유전자 수도 적어 개별 미생물의 기능이 매우 제한적이기에 독자적으로 생존하기 쉽지 않기 때문"1)으로 볼 수 있습니다. 사실 그 이유는 인간도 마찬가지일겁니다. 우리는 온갖 위험이 도사리는 지구, 그 안에서도 서로 위협이 되는 우리 사회에서 혼자 살아남기엔 유전자 발현 역량이 부족합니다. 그렇기에 우리는 국가라는 틀 안에서 집단을 이루어 여러 사람들이 함께 각자가 가진 역량을 최대한 발휘해야 지속적으로 살아남을 수 있습니다. 똑똑한 한 명이 아니라 부족하더라도 함께 모여 만든 집단 지성이 세상을 바꿉니다. 물론 인간 사회에선 영향력 있는 한 명의 사람이 좋은 쪽이든 나쁜 쪽이든 집단 지성을 만들어낼 수도 있지만요. 그렇다 해도 결국 큰 영향력을 발휘하는 건 여러 사람이 모여 형성한 '집단'입니다. 우리 몸에서 집단을 이루고 있는 미생물들의 종류는 다양합니다. 최근에 읽고 있는 생물정보학 책에서 말하길, 인간의 장에는 약 500종의 다양한 미생물이 있으며, 그 중 10% 정도가 전체 세균 개체 수의 99%를 차지하고 있을 것으로 추정된다3)고 합니다*. 그렇다면, 왜 이러한 미생물들은 우리의 '장(gut)'에 거주하는 것이며, 우리의 면역계는 왜 장에 거주하는 미생물들을 외부 침입자로 판단해 죽이지 않고 살려두는 걸까요? 면역의 핵심은 '자기'와 '타자'를 구분하는 것이라고 하는데, 미생물은 아무리 생각해도 타자인데 말이죠. 그 이유는 다음과 같습니다.
* 참고로, 장내 미생물의 대부분은 세균(bacteria)이지만, 바이러스, 진균(fungi), 고세균(archea) 등도 장내 미생물에 포함된다4)고 합니다.
우리 조상들은 한 무리의 미생물종과 위험한 거래를 했다. 인간은 미생물에게 길고 따뜻한 터널을 살 곳으로 내주고 끊임없이 먹을 것을 공급하는 대신 세균(미생물)은 우리가 소화할 수 없는 탄수화물을 분해하고 우리 스스로 만들지 못하는 비타민을 생산해주기로 한 것이다. 장내 미생물 총의 세균은 말하자면 세입자로 이런 자원들을 집세로 내는 셈이다. 이런 세균을 공생균이라 한다. 2)

다시 말해 우리의 장은 공생균에게 먹이와 서식지를 제공해줍니다. 그리고 미생물은 우리가 소화할 수 없는 식이섬유 같은 탄수화물을 분해하고, 스스로 합성할 수 없는 비타민(ex. B, K)을 생산해주며 서로가 서로에게 도움을 주고 있죠. 심지어 장내 미생물은 뒤에서도 설명하겠지만, 면역의 '목적'이라고도 볼 수 있는 면역계 항상성 유지에도 도움을 줍니다.
우리 몸에서 대부분의 영양소 흡수가 이루어지는 곳은 바로 '장(gut)'이죠. 따라서 미생물은 장에 거주하며 먹이와 안전한 서식처를 제공받습니다. 물론 인체 내에서도 위치에 따라 환경(ex. pH, 온도, 습도)이 조금씩 다르고, 다양한 종류의 장내 미생물들은 각자의 생존에 적합한 환경이 있기에 장 내에서도 특정 미생물이 거주하기 유리한 공간이 구분됩니다. 책에서는 다음과 같이 설명합니다.
장의 대표 세균 문으로는 의간균(Bacteriodetes)과 후벽균(Firmicutes)이 알려져 있다. 장은 크게 소장과 대장으로 구분되는데, 소장은 대장에 비하여 산소 농도는 높은 반면, 낮은 pH와 높은 항균성 물질로 인하여 박테리아의 밀도가 높지 않다. 이러한 장내 미세환경 차이로 인하여 소장에서는 젖산균과(Lactoabiliaceae)와 장내세균과(Eneterobacteriaceae) 계통이 우세한 반면, 대장은 장내세균과, 박테로이드과(Bacteroidaceae), 프리보텔라과(Prevotellacea), 리케넬레과(Rikenellacea), 라크노스피라과(Lachnospiracae) 및 루미노코과(Ruminococcacea) 계통의 세균들이 두드러지게 나타난다. 1)
참고로, 사람들은 각자 다른 장내 미생물 조성(gut microbiota composition)을 가지고 있으며, 같은 사람이더라도 식단, 라이프스타일 등이 변화함에 따라 장내 미생물 조성이 달라질 수 있습니다. 사람의 장 환경의 차이에 따라, 그리고 특정 개인의 장 환경 변화에 따라 생존에 적합한 장내 미생물 종류가 달라질 수 있기 때문이죠. 중요한 것은 장내 미생물(대부분 세균)의 분포는 매우 편향되어 있으며, 대부분의 부위에 소수의 우세한 종과 소수의 희귀종이 존재한다3)는 점입니다. 앞서 말했듯 전체 장내미생물 유형 중 10% 정도가 전체 장내미생물 개체수의 99%를 차지하고 있을 것으로 추정됩니다. 이러한 장내미생물은 그저 조용히 장에서 거주만 하고 있는게 아니죠. 장내 미생물 조성은 숙주의 신체 기능(ex. 대사, 면역)에 영향을 미칠 수 있습니다. 즉, 장내 미생물 조성의 변화는 건강한 상태에서 대사 장애, 면역 질환 등 다양한 질환으로 이어지는데 영향을 미칠 수 있는 것은 물론, 질병을 치료하여 다시 건강한 상태를 복구하는 데에도 영향을 미칠 수 있습니다(다음 장에서 장내 미생물이 암과 같은 질병에 미치는 영향, 그리고 그 다음 장에서 장내 미생물 조성 변화를 통한 건강 회복을 목표로 하는 '장내 미생물 기반 치료제(gut microbiota-based therapy)'에 대해 자세히 살펴볼 예정입니다).
결국 기억해야 할 건 유익균(beneficial bacteria)과 유해균(harmful) 사이의 균형을 유지하는 것이 건강에 중요하며, '유익균 감소 및 유해균 증가' 혹은 '장내미생물 다양성 감소' 등으로 균형이 깨지게 된 장내 미생물 불균형 상태(dysbiosis)는 대사 장애, 자가면역질환, 암, 뇌질환 등 수많은 질병으로 이어질 수 있다는 것입니다. 심지어 장 내에서 숙주의 소화 및 대사에 좋은 영향을 주던 미생물이 특정 요인(ex. 염증)으로 인한 환경의 변화로 인해 병을 일으키는 '병원균(pathogen)'이 될 수도 있습니다. 이러한 장내 미생물 중 하나가 바로 '기회감염균(opportunistic pathogens)'입니다.

우리 장에 거주하는 대표적인 기회 감염균은 바로 '클로스트리디움 디피실균(Clostridioides difficile)'입니다. 이 친구는 항생제 남용이나 심한 스트레스 등으로 장내 미생물 균형이 깨지면 폭발적으로 증식하여 중증 장염을 유발할 수 있습니다. 구체적으로, 클로스트리디움 디피실균은 장 내벽(intestinal lining)에 손상을 가하는 강한 독소들(potent toxins)을 생산함으로써 중증 대장염과 생명을 위협하는 설사(life-threatening diarrheea)를 야기할 수 있는데요4). 이러한 경우 정상 미생물균 총을 회복시키는 방법 즉, 장내 미생물 균형을 복구하는 방법이 매우 효과적이라고 합니다. 실제로, 클로스트리디움 디피실균(C. difficile) 감염 환자에게 분변미생물이식(FMT) 즉, 건강한 공여자의 분변 미생물을 이식한 약 89~90% 환자에서 감염이 억제되고 병이 호전되었다5)고 보고되기도 했습니다.
C. difficile 감염이 문제가 되는 건 그들이 단지 장 내벽의 손상을 가하는 독소를 생산하기 때문 만이 아닙니다. C. difficile 감염은 환자의 공생균 대부분이 줄어드면서 나타나기에, 단쇄지방산(SCFA, short chain fatty acid)과 2차 담즙산(secondary bile acids) 생성 감소로 인체 기능에 문제를 일으킵니다5). 그 공생균들은 장에서 SCFA와 2차 담즙산을 생성해주고 있었기 때문입니다. 그렇기에 건강한 장내미생물(공생균)들이 존재하는 분변을 환자에게 이식함으로써 결장의 염증 개선은 물론 SCFAs와 2차 담즙산을 정상 수준으로 복구하도록 하는 것이죠. 그렇다면 궁금해집니다. 건강한 장내 미생물들은 어떻게 해서 SCFAs와 2차 담즙산을 생성할 수 있는 걸까요? 그리고 장내 미생물이 생산하는 SCFA와 2차 담즙산은 몸에서 어떤 역할을 하고, 이 두 가지 물질의 생성이 감소하면 몸에선 어떤 문제가 발생할까요? 이에 대해 간단히 알아보겠습니다.

장내미생물은 사람이 소화할 수 없는 식이섬유(dietary fiber)를 발효하여 아세트산(acetate), 프로피온산(prioponate), 부티르산(butyrate)과 같은 단쇄지방산(SCFA, short chain fatty acid)을 생성합니다*. 대표적인 예로, 우리 몸의 유익균인 비피도박테리움(Bifidobacterium)은 식이섬유를 분해해 SCFA의 일종인 아세트산을 생산함으로써 장세포를 위한 에너지를 제공해 건강한 장 환경 유지에 도움을 준다4)고 하죠. 아래 영상에서 비피도박테리움이 소화계에서 어떤 역할을 하는지 3D 영상으로 소개해줍니다.
* 장내 미생물은 탄수화물 분자들로부터 푸마르산(fumarate), 숙신산(succinate), 그리고 젖산(lactate)과 같은 중간 발효 산물들(intermediate fermentation products)을 생산하기도 하는데요. 이러한 산물들은 다른 미생물들이 프로피온산(propionat)이나 부티르산(butyrate)으로 전환하기 때문에 건강한 환자의 대변에서는 잘 검출되지 않는다고 합니다7)(반면, 궤양성 대장염(UC) 환자의 경우엔 젖산이 많은 양이 검출된다7)고 하는데, UC에선 장내 미생물 불균형이 발생하기 때문으로 추정할 수 있겠습니다). 이렇듯 특정 미생물이 생산한 대사 산물이 다른 미생물에 의해 대사되는 그런 현상을 'Bacterial cross-feeding'이라고 합니다.
이러한 SCFA( acetate prioponate, butyrate)의 정성적 및 정량적 구성은 장내미생물 조성, 섭취한 식이섬유의 종류 등에 따라 달라진다6)고 하는데요. 장내미생물 조성에 따라 SCFA의 구성이 달라지는 이유는 장내미생물마다 생산하는 SCFA가 조금씩 다르기 때문입니다. 예로, 대부분의 장내 미생물은 프로피온산 혹은 부티르산을 생산하는 능력을 갖추고 있지만, 이 두가지 모두를 생산하는 미생물은 적다7)고 하죠.

SCFA는 다양한 측면에서 장 환경에 영향을 미칠 수 있습니다. 우선, SCFA는 '산(Acid)'인 만큼 장내 pH에 영향을 미칠 수 있는데요. SCFA에 의해 산성화된 장 환경은 산성조건에서 생육이 저해되는 유해균의 생균수를 감소시킬 수 있다6)고 합니다. 대표적인 예로, 장 세포에 침입해 염증 반응을 유발할 수 있는 살모넬라균(Salmonella)의 대부분은 pH 4.5 아래의 환경에서 생존할 수 없다15)고 알려져 있습니다.
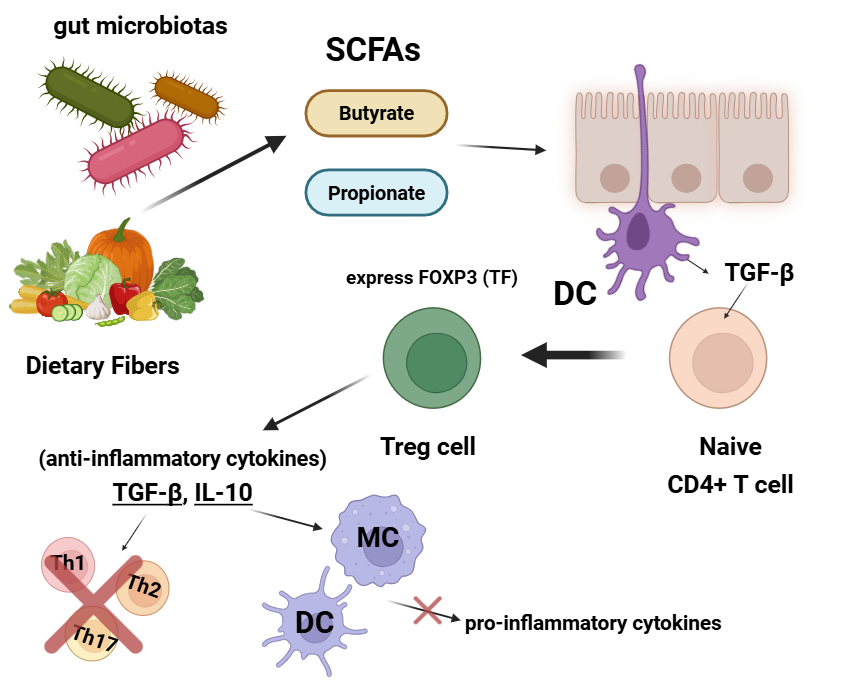
또한, SCFA는 장 상피세포의 에너지 자원으로 사용되어 gut intestinal integrity를 유지하는데에도 도움을 줄 수 있습니다. 구체적으로, SCFA는 장 상피세포벽을 견고하게 만드는 접착제의 역할을 하는 '치밀 연접 단백질(tight junction protein)'의 기능을 향상시켜 장벽을 튼튼하게 만드는 데 기여합니다13). 마지막으로, SCFA는 면역세포의 증식 및 분화에 영향을 미칠 수 있는데요. 그 예로, SCFA(대표적으로 부티르산과 프로피온산)는 수지상세포가 TGF-β를 분비하도록 유도할 수 있습니다. 여기서, TGF-β는 Naive CD4+ T cell이 조절 T 세포인 Treg cell로 분화하도록 유도하는 사이토카인이죠. 이후 Treg cell 또한 TGF-β를 분비해 Foxp3+ Treg 분화 및 기능 유지에 중요한 역할을 합니다*. 여기서 TGF-β는 주로 Th1, Th2, Th17 세포 등 염증 유도에 중요한 조력 T 세포의 분화 및 작용을 억제하여 항염증 반응을 유도한다*고 잘 알려져 있으며, 따라서 Treg 세포는 항염증 기능을 하는 세포로 잘 알려져 있습니다(이외에도 최근에는 TGF-β가 상처 치유 과정 및 조직 재생에도 관여한다11)고 보고되기도 했습니다).
* Foxp3는 Treg의 발달 및 증식에 핵심적인 역할을 하는 단백질입니다.
* TGF-β는 Naive CD4+ T 세포가 Treg로 분화되도록 강력하게 유도하여 염증 유도 T 세포(Th1, Th2, Th17)의 활성을 간접적으로 억제할 수도 있지만, 염증성 T 세포가 가진 분화 관련 전사인자(T-bet, GATA-3, RORγt 등)의 발현을 직접적으로 억제하여 염증 유도 T 세포(Th1, Th2, Th17)로의 분화 및 기능을 감소시킬 수도 있습니다(챗GPT 답변 참조).
Treg cell은 사실 TGF-β 말고도 또 다른 항염증성 사이토카인(anti-inflammatory cytokine)인 인터루킨-10(IL-10)도 분비한다고 잘 알려져 있는데요. IL-10은 대식세포, 수지상세포 등 선천면역세포가 분비하는 염증성 사이토카인의 발현을 감소시킨다고 알려져 있으며, 만약 IL-10 발현 기능이 손상되면 미생물에 대한 염증 반응이 증가해 IBD(inflammatory bowel disease)나 자가면역질환 발달로 이어질 수 있습니다*. 따라서 장내미생물의 Treg 세포 증식 유도는 TGF-β, IL-10 등 항염증 사이토카인 분비를 유도해 과도한 염증 반응을 방지하는데 주요 역할을 합니다.
* 물론 IL-10은 T세포, B 세포 등 후천면역세포의 활성 및 증식 신호를 강화할 수 있으며12), 이는 IL-10이 세포(선천면역세포, 후천면역세포)의 수용체와 결합하여 활성화되는 STAT3 같은 신호전달경로가 세포 종류에 따라 다른 반응을 유도할 수 있음을 보여줍니다. 결국 IL-10은 선천면역세포의 과도한 염증반응으로 인한 조직 손상을 막으면서도, 효과적인 후천 면역 반응을 유지하는 역할을 합니다.
최근 한 연구11)에서는 scRNA-seq을 통해 무균(GF, germ free) 생쥐들과 장내미생물이 존재하는(SPF, specific pathogen free) 생쥐들에서 추출한 colonic Treg 세포를 대상으로 유전자 발현 패턴을 비교하였는데요. 그 결과 두 조건 간의 Treg 세포의 활성화 경로에 차이가 나타났으며(GF : pdcd1_path, SPF : cxcr3_path), 장내 미생물이 존재하는 생쥐의 Treg 세포들에서 무균 생쥐의 Treg 세포들에 비해 보다 높은 항염증 기능이 나타났다11)고 합니다. 결국 장내 미생물은 Treg 세포의 분화는 물론 Treg 세포의 기능(활성화 경로)에도 영향을 미쳐 장에서의 과도한 염증 반응으로 몸의 기능이 망가지는 일을 막아주는 역할을 한다고 볼 수 있겠습니다. 장에서 과도한 염증 반응이 몸의 기능을 망가뜨릴 수 있는 이유는 장에서는 영양소 흡수와 같은 몸의 기능 유지에 필수적인 기능들이 이루어지고 있기 때문이죠.
장의 면역계는 꼭 필요한 경우가 아니라면 염증을 일으키고 싶어하지 않는다. 염증이 일어난다는 것은 많은 채액이 장으로 몰린다는 뜻이다. 당연히 설사가 일어난다. 설사는 그저 물 같은 변을 보는 것이 아니다. 음식 속 영양소를 우리 몸 속으로 흡수하는 매우 얇고 예민한 세포층이 손상되어 떨어져 나가는 현상이다. 2)

그렇다면 염증(inflammation)이란 무엇일까요? 위의 구절을 언급한 책에서의 염증에 대한 설명을 요약하자면, 염증은 혈관이 확장되면서 외부 침입균을 제거할 수 있는 면역세포(ex. 중성구, 대식세포), 보체와 같은 공격용 단백질 등이 담긴 혈장이 상처를 입었거나 감염된 조직에 충분히 흘러가도록 하는 과정2)입니다. 이러한 염증 반응은 신속한 대처를 통해 감염을 특정 부위에 국한시켜 감염이 더 이상 퍼지지 않도록 막는 것이 목적입니다. 그렇다면 우리 몸은 어떤 자극을 받아야 혈장이 특정 조직 부위에 몰려 들게 하는 염증 반응을 일으킬 수 있는 걸까요? 책2)에서는 염증은 자연적이지 않은 방식으로 죽은 세포를 면역계가 인지하면서 시작된다고 설명합니다. 정상적으로 죽은 세포는 세포 자멸사(apoptosis)를 통해 깔끔하게 삶을 마감합니다. 허나, 자연적이지 않은 방식으로 죽은 세포(necrosis)는 내부에 들어있던 내용물을 사방에 흩뿌리게 되고, 그 세포 내용물들은 면역계를 강하게 자극해 염증성 사이토카인들이 분비되면서 염증을 일으키게 되죠. 특히 죽은 세포로부터 방출되어 나온 '미토콘드리아의 DNA'는 오래 전에 진핵세포로 들어가 공생하게 되었을 것으로 추정되는 원핵생물의 DNA인 만큼 면역세포는 그 DNA를 마치 바이러스의 DNA처럼 '우리 몸을 침범한 타자'로 간주해 면역세포들은 이에 대해 격렬한 공격을 퍼부어 대응한다2)고 합니다.

보다 구체적으로 설명하자면 우리 몸에서 자연적 혹은 자연적이지 않은 방식으로 죽은 세포들의 조각은 조직에 상주해있는 대식세포(Macrophage)들이 수거해 재활용합니다. 이때 대식세포가 외부 침입균에 의해 자연적이지 않은 방식으로 죽은 세포를 감지하게 되면 활성화되면서 공격적인 청소부가 되는 것은 물론(이후 후천면역으로 이어지면 조력T세포(Th1)가 대식세포의 활성을 돕습니다), 'IL-8(CXCL8)'이라는 사이토카인을 분비해 수명이 짧으면서도 주변을 난장판으로 만드는 공격적인 전투병인 '중성구(Neutrophil)'를 염증 부위로 불러들입니다. 중성구는 외부 침입균에게 '과립(granule)'이라는 독한 산을 투척하거나, 스스로 자폭해 'NET(Neutrophil Extracellular Trap)'이라는 치명적인 덫을 형성하여 세균들이 몸속으로 더 깊이 침입하지 못하게 막습니다. 문제는 이러한 중성구의 공격은 특이성이 없다는 것입니다. 즉, 정상적인 건강한 세포도 죽일 수 있습니다.결국 염증은 우리 몸의 감염이 확장되는 것을 신속하게 막기 위한 효과적인 방어 전략이긴 하지만, 우리 몸의 정상 세포에게까지 피해를 입혀 장염과 같은 질환으로 이어질 수 있습니다. 그렇기에 숙주의 항염증 반응을 도울 수 있는 장내미생물의 균형 유지가 중요하다는 것을 다시 한번 기억해야 될 것 같습니다. SCFA에 대한 내용이 길어졌는데, 장내 미생물이 생산하는 또 다른 물질로 '2차 담즙산'이 있다고 했었죠.

담즙산(Bile Acids)은 간에서 콜레스테롤로부터 생성되며, 지방 소화(fat digestion)를 위해 장으로 배출되는 물질입니다. 그리고 이러한 담즙산은 장내 미생물에 의해 변경될 수 있습니다. 구체적으로, 장내 미생물은 1차 담즙산(primary bile acid)을 2차 담즙산(secondary bile acid)으로 전환하는데요. 그 근거로 최근 연구에서는 항생제 처치 후(다시 말해, 장내 미생물 제거 후) 대변의 담즙산(fecal bile cids)에서 1차 담즙산은 증가, 2차 담즙산은 감소되었다는 연구결과가 나타났다9)고 합니다. 담즙산은 지질 소화(lipid digestion), 콜레스테롤 대사(cholestrol metabolism)와 같은 숙주의 대사 및 조절 경로 주요 역할을 하는 물질9)입니다. 그만큼 장내 미생물 감소로 인한 담즙산 불균형은 대사 장애, 소화 장애 등 우리 몸에 문제를 일으킬 수 있습니다.
그 외에도 장내 미생물은 미생 숙주(인간)가 할 수 없는 비타민 합성(B, K)을 대신해줍니다. 예로, 사람의 대표적인 장내 미생물 속(genera) 중 하나인 Firmicutes는 혈액 응고에 필요한 비타민 K를 합성합니다*. 이러한 일이 가능한 건 장내 미생물엔 우리 사람 게놈에는 암호화되어 있지 않은 특정 화학물질을 분해하는 효소 활동들(enzymatic activities)이 존재하기 때문입니다. 결국 장내 미생물 군집(Microbiome)은 장 내에서 숙주가 할 수 없는 방식으로 다양한 대사산물을 생산 및 가공처리하며, 숙주의 면역계 항상성 유지에 핵심적인 역할을 한다고 볼 수 있겠습니다. 다시 말해, 장 환경은 장내 미생물은 물론 점막 층(mucosal layer), 면역세포, 그리고 상피세포들의 다이나믹한 상호작용이 이루어지는 복잡한 생태계8)로, 장내 미생물 조성의 변화나 다양성 감소는 면역 불균형을 야기하며 각종 질환 발생으로 이어질 수 있습니다.
* 위의 구절에서 잠깐 언급하긴 했지만 사람의 대표적 장내 미생물 속은 Firmicutes(그람 양성균)와 Bacteriodetes(그람 음성균)입니다.
미생물 종이 숙주 면역계를 조정하고 교육하는 능력은 유아기(infancy) 시기부터 시작하게 되는데요. 장에 상주하는 면역세포들에 항원을 전달함으로써 장내 공생균에 대한 면역 관용(immune tolerance)을 촉진하면서, 병원균이 침입했을 땐 그들을 빠르게 제거할 수 있도록 면역계를 교육시킵니다. 어렸을 때 다양한 종류의 세균들이 가득한 흙에서 뛰어 노는게 각종 질병 예방에 도움이 되는 이유가 바로 어렸을 때부터 면역계가 다양한 세균들로부터 침입 대처 훈련을 많이 받을 수 있기 때문이죠.
참고로, 장의 점막층은 병원균의 내부 침입을 막기 위한 3개의 층으로 구성되어 있는데요. 첫번째 층은 바로 점액(mucin)입니다. 점액에는 세균을 무력화하는 항체(IgA), 그리고 세균을 죽이거나 손상시킬 수 있는 디펜신(defensin)과 같은 단백질이 가득 들어있습니다2)*. 문제는 장내 점액층은 매우 얇으며 영양소 흡수를 위해 군데 군데 구멍이 나있으며2), 염증과 같이 몸에 이상 신호가 왔을 때도 점액층이 뚫릴 수 있다는 것인데요. 그렇게 점액 층을 뚫고 들어온 병원균은 점막의 두번째 층인 상피세포벽을 마주하게 됩니다.
* 점액층의 항균 기능을 돕는 공생균이 있습니다. 예로, 아커만시아 뮤시니필라(Akkermansia muciniphila)는 점액(mucin)을 분해함으로써 그 부산물을 자신의 에너지원으로 사용하고, 그 과정에서 오래된 점액을 제거합니다. 그렇게 배상세포(Globlet cell)로부터 새로운 신선한 점액이 분비되도록 하여 점액층의 재생과 개선을 유도하죠. 이를 통해 우리는 신선한 점액으로 병원균이 장벽에 침입하는 걸 방지하며 gut barrier integrity를 유지합니다(즉, 장벽을 튼튼하게 만듭니다)4). 그만큼 아커만시아(Akkermansia)는 염증 감소, 포도당 대사 향상, 비만과 당뇨로부터의 보호 등과 같은 건강 상태와 연관성이 보고된 것은 물론, 숙주의 면역계와 상호작용하여 항염증 분자들의 생산을 촉진할 수 있어 질병 치료 잠재력을 보이고 있습니다4).
문제는 이 상피세포벽은 두께가 '1개의 세포들'에 불과하다는 거죠. 그래도 1개의 두께로 된 상피세포들이 서로 부착해 촘촘한 대열을 지어 병원균의 내부 침입을 막습니다. 이러한 상피세포들의 촘촘한 대열은 앞서 말한 SCFA가 형성에 도움을 주는 '치밀 연접(tight junction)'을 통해 가능합니다. 문제는 특정 세균, 예를 들어 박테로이데스 프라길리스(Bacteroides fragilis)*는 상피세포들 사이의 치밀 연접을 파괴하는 독소를 생산할 수 있다4)는 것입니다.
* 참고로, 염증성 작용을 촉진하는 독소형(enterotoxigenic) B. fragilis (ETBF)와 달리 비독소성(non-toxigenic) B. fragilis (NTBF)는 항염증성 작용을 보입니다. NTBF가 분비하는 캡슐성 다당류인 Polysaccharide A (PSA)는 숙주의 DC나 CD4+ T 세포의 TLR 2 수용체와 결합하여 조절 T세포의 분화를 유도하고, 항염증성 사이토카인인 IL-10 분비를 촉진할 수 있다고 알려져 있습니다.
사실 그러한 독소를 만들지 않더라도 우리 몸에는 37조개의 세포 수만큼이나 장내 미생물들이 존재하기에 일부 공생균이 상피세포벽을 뚫고 내부로 들어오는 일이 벌어질 수 있으며, 지금 이 순간에도 끊임없이 그런 일이 벌어지고 있습니다2). 그렇게 침입한 병원균은 장 점막의 세번째 층인 고유층(lamina propria)에 존재하는 면역세포들이 제거합니다. 예로, 고유층에 존재하는 대식세포(Macrophage)가 병원균 제거를 돕습니다*.
* 장 점막의 상피세포벽 사이사이에는 세포독성 T세포(CTL)가 위치해있으며, 고유층에는 조력T세포와 세포독성 T세포가 3:1의 비율로 존재한다14)고 알려져 있습니다. 여기서 조력T세포는 대식세포의 활성화에 역할을 하는 반면, 세포독성T세포는 세균에 감염된 세포의 MHC 클래스 1 분자를 인식해 세포자멸사를 유도하는 역할을 합니다(세포 내에서 세균 단백질이 들어와 분해되고, 이로 인해 외래 항원이 MHC 클래스 1 분자에 결합할 수 있게 됩니다).
장을 지키는 대식세포는 두 가지 특징을 갖는다. 첫째, 세균을 삼키는데 매우 능하다. 둘째, 중성구를 불러들이고 염증을 일으키는 사이토카인을 방출하지 않는다. 부산 떨지 않으면서 국경을 넘은 세균을 조용히 집어삼키는 침묵의 살인자다. 2)
앞서 말했듯 중성구를 불러들이거나, 염증 반응을 통해 보체계를 활성화한다면 마치 전쟁처럼 우리 쪽의 피해도 만만치 않게 커집니다. 따라서 후천 면역의 도움이 필요합니다. 감사하게도 장 가까이에 후천면역세포들이 집결할 수 있는 림프소절이 있습니다. 이는 마치 병원균을 표적으로 하는 트랩처럼 존재합니다. 다시 말해, 병원균이 장벽에 있는 상피세포를 통과하지 않고도 벽을 통과하도록 유인한 다음 그 병원균에 대한 면역반응을 유도합니다. 구체적으로, 병원균들은 상피세포 대신 융털도 없고 점액층도 없어 쉽게 들어올 수 있는 장벽 곳곳에 위치한 M 세포를 통해 소장에 위치한 림프소절인 '파이어판(Peyer's patch)'으로 입장하게 됩니다. 그러나 이건 병원균에게 있어 트랩이자 함정이죠. 파이어판은 소장 내 림프조직 덩어리이자 점막면역(GALT)의 중심지로, IgA를 분비하는 B세포, 수지상세포 등이 집결해있기에 세균을 사멸시키고, 세균에 대한 면역기억을 형성하도록 유도합니다. 대식세포가 상주한 '조직'이 아닌 '림프절'에서도 세균을 죽일 수 있는 이유 중 하나는 B 세포가 IgA 항체를 대량으로 만들어내기 때문입니다(물론 IgE 항체를 통해 기생충 감염 방지를 빙자한 알레르기 반응을 유발할 수도 있습니다*). 이 IgA는 림프절에서 만들어진 뒤 점액층에 분비되며 두 항체의 불변 부위(constant region)가 붙어 있어 다른 항체와 달리 보체계를 활성화하지 않고, 염증도 유발하지 않습니다. 그 대신 항원을 인식하는 가변부위의 집게발이 아래 이미지에서 보듯 총 4개인 만큼 세균들을 붙잡아 한 덩어리로 만들 수 있습니다. 참고로, 대변의 약 30퍼센트가 IgA 항체에 의해 떡처럼 서로 영겨진 세균 덩어리2)라고 하죠.
* IgE 항체의 역할을 간단히 설명하자면, 알레르겐, 기생충 등을 인식하여 (그리고 같은(혹은 유사한) 항원을 DC를 통해 인식한 조력 T세포(Th2)의 도움으로) 활성화된 B 세포에서 분비된 IgE 항체들이 비만세포(Mast Cell)의 Fc 수용체에 붙게 됩니다. 이후 비만세포가 IgE 항체를 통해 기생충이나 알레르겐(allergen)을 인식하게 되면 비만세포가 활성화되어 수명이 연장되고, 탈과립(degranulation)을 시작해 비만세포 내 히스타민과 같은 화학물질들이 분비되어 발열 등 과민성 염증 반응이 촉진됩니다2). 이는 대식세포나 수지상세포가 포식할 수 없는 '기생충' 감염에 대항하기 위한 효과적인 염증 증폭 전략이긴 하나, 기생충이 아닌 땅콩 같은 알레르겐에 대항하기 시작하면 생명을 위협할 수도 있는 알레르기 반응이 나타납니다(이러한 반응의 지속은 IgE 항체가 붙을 수 있는 또 다른 면역세포인 호염구와 호산구가 돕습니다).

사실 친화도 높은 항체를 분비하는 B세포가 활성화 되기 위해서는 두 가지 면역세포들의 활성 신호가 필요합니다. 먼저 B 세포는 골수에서 만들어지고 골수에서 성숙 과정을 거친 뒤, 파이어판과 같은 림프절에 상주하게 되는 만큼 B 세포의 기능을 위해서는 먼저 항원이 림프절로 유입되어야 합니다. 다시 말해, B세포는 마치 대식세포나 수지상세포처럼 항원을 섭취(intake)하여 그 항원 펩티드 조각을 MHC 클래스 2 분자에 제시합니다. 일반적인 경우 B세포가 세균을 항원으로 인식할 때 세균에 결합한 보체들이 B세포가 보다 쉽게 항원을 인식하도록 돕는데요. 장에서는 염증과 같은 왠만한 경우가 아닌 이상 보체계가 고전경로를 통해 대규모로 활성화되지 않는 만큼 B세포의 항원 인식에 있어 보체의 기여는 제한적이라고 볼 수 있겠습니다. 그렇다 해도 보체의 도움 없이도 B세포는 항원을 인식할 수 있고, 인식한 항원을 섭취하여 MHC 클래스 2 분자에 펩티드 형태로 제시하며 항원제시세포로서 역할을 합니다. 이후엔 MHC 클래스 2 분자에 끼워진 펩티드를 인식할 수 있는 조력 T 세포가 그 B세포가 친화도 높은 항체를 분비할 수 있도록 활성화시켜줍니다. 이때, 조력 T세포가 B 세포를 활성화하기 위해선 먼저 수지상세포가 그 조력 T세포를 활성화시켜야 합니다. 결국 후천면역의 시작은 수지상세포입니다. 수지상세포(Dendritic Cell)는 항원제시세포인 만큼 병원균으로부터 표본을 수집해 후천 면역을 활성화하는데요. 구체적으로, 병원균에서 유래된 조각들을 섭취(uptake)한 다음 잘라서 MHC 클래스 2 분자에 펩티드 형태로 제시해, 림프절에 해당 펩티드를 인식할 수 있는 TCR(T 세포 수용체, T cell receptor)을 가진 조력T세포를 활성화합니다.

그렇게 활성화된 조력 T세포는 증식을 한 뒤(clonal expansion), 세균을 포식작용(phagocytosis)을 통해 죽이는 대식세포를 활성화하기 위해(IFN-γ 등을 분비함으로써) 염증부위로 이동하거나, 앞서 말했듯 림프절에서 자신(조력T세포)과 같은(혹은 유사한) 항원을 인식하는 B 세포의 항원 펩티드가 결합된 MHC 클래스 2 분자를 인식해 그 항원에 대항하는 항체를 분비하도록 합니다. 이때, 조력T세포로부터 활성화된 B세포는 체세포 돌연변이(somatic hypermutation)을 통해 친화도 성숙(affinity maturation)을 거치게 됩니다*. 또한, 형질 전환(class switching)을 통해 B세포가 초기에 발현하는 IgM을 IgA로 전환해 보다 효과적으로 세균을 중화하거나(세균이 분비한 독소 중화, 바이러스의 경우 세포에 침투하지 못하게 막음), 옵소닌화(대식세포가 더 잘 포식할 수 있도록 도움)할 수 있도록 합니다.
* 돌연변이는 방향성이 존재하지 않습니다. 따라서 체세포 돌연변이(항체의 항원 인식부위의 변화에 기여)를 겪은 B세포는 항원에 대한 특이성이 높아질 수도 있고, 낮아질 수도 있는데요. 항원에 대한 특이성이 높은 방향으로 돌연변이가 된 항체(= BCR)를 가진 세포는 또 다시 조력T세포로부터 활성신호를 받게 되고, 특이성이 낮아지는 방향으로 돌연변이가 된 항체를 가진 세포는 조력T세포에 의해 활성화되지 못해 자멸사하게 됩니다.
물론, 장에서는 조력T세포의 직접적인 도움 없이 수지상세포나 상피세포가 분비하는 TGF-β와 같은 사이토카인이 B세포를 자극해 IgA로의 형질 전환을 유도할 수 있습니다. 조력T세포의 도움을 받아 항체를 만들기엔 시간이 너무 많이 걸리기 때문입니다. 구체적으로, 조력T세포의 도움으로 항체를 분비하려면 수지상세포가 림프절로 가서 자신이 수집한 항원(MHC 클래스 2에 제시)을 인식하는 TCR을 가진 조력 T세포를 활성화해야 하고(그런 T세포를 찾아야 하고), 이후 조력 T세포는 자신과 동일한(혹은 유사한) 항원을 인식하는 B세포가 세포 표면에서 제시하는 MHC 클래스 2 분자를 찾아 TCR로 인식해야 하고(그 전에 보체의 도움 없이도 B세포는 항원을 인식해 그 항원의 펩티드를 MHC 클래스 2에 발현해야 하고), B세포는 체세포 돌연변이를 통해 친화도 성숙을 일으킨 뒤 형질 전환을 통해 IgA를 분비해야 합니다. 듣기만 해도 오래걸릴 것 같지 않나요? 그만큼 처음 들어온 항원에 대한 항체를 형성하는 과정에서 이미 병원균(항원)은 체내로 짐입해 혈관을 타고 곳곳을 누비며 우리 몸 곳곳의 기능을 망가뜨리고 있을 수 있습니다(참고로, 처음 들어온 항원에 대하여 선천 면역이 후천 면역으로 이어지기 까지는 보통 7일~10일 정도 걸린다고 합니다*). 따라서 병원균의 침입을 신속하게 저지하고자 수지상세포나 상피세포는 TGF-β와 같은 사이토카인을 분비해 B세포가 조력T세포의 도움 없이도 신속하게 IgA를 분비하도록 유도하는 것이죠. 물론 조력T세포에 의한 친화도 성숙은 거치지 않았기에 항원 특이성은 떨어지겠지만요. 이러한 IgA는 중화 및 옵소닌화에 역할을 하긴 하지만, 앞서 말했듯 다른 항체와 달리 보체계를 활성화하진 않는데요(물론 주 작용은 아니지만 렉틴 경로나 대체 경로를 통해 보체계를 활성화시킬 순 있다고 하네요14)). 보체계에 대한 설명은 아래 영상을 참고 바랍니다.
* 바이러스에 대한 보다 신속한 적응면역 활성화를 위해 우리는 백신을 접종하곤 합니다. 백신은 우리 몸의 면역계가 해당 바이러스 항원을 미리 ‘학습’하게 하여 기억 면역세포(적응면역세포)를 형성합니다. 이렇게 생긴 기억 T세포와 기억 B세포는 나중에 실제 바이러스가 침투했을 때 빠르게 감염을 억제하고 제거하는 역할을 하는데요. 구체적으로, 한 번 항원을 인식하여 활성화된 T세포와 B세포들 대부분은 면역 반응이 끝난 뒤 사멸하지만, 그중 일부는 그 항원을 기억하는 상태로 살아남아 ‘메모리 풀(memory pool)’을 형성합니다. 이후 같은 바이러스 항원이 다시 들어오면, 이 기억 T/B세포들은 초회 면역 반응(primary immune response)과 달리 복잡한 보조 자극(2차 신호)이나 수지상세포의 항원 제시에 크게 의존하지 않고도, 이전보다 훨씬 낮은 역치로 빠르게 활성화됩니다. 다시 말해 선천 면역이 후천 면역으로 이어지기까지 7~10일 정도까지의 긴 시간이 걸리지 않는다는 말이죠. 예를 들어, 기억 CD8⁺ T세포는 항원을 재인식하면 재활성화되어 effector CD8+ T세포가 되어 곧바로 해당 바이러스에 감염된 세포를 제거하기 시작하고, 기억 B세포는 재활성화되어 형질세포(Plasma cell)로 분화한 뒤 고도의 친화도를 가진 항체(이미 친화도 성숙과 항체 종류 전환을 거쳤기 때문)를 신속히 분비하여 감염을 막아냅니다.
우리 몸에는 조력 T세포 외에도 T 세포 중 약 40 퍼센트를 차지하는 살해 T세포(CD8+ T cell)가 있습니다. 살해 T세포는 세포들이 자신의 정체성(identitiy)을 나타내는 세포질 유래 항원이 결합해 있는 MHC 클래스 1 분자를 인식해 그 세포에서 비정상적인 단백질(ex. 바이러스 단백질)이 만들어지는지 파악하고 문제가 있는 단백질 펩티드가 MHC 클래스 1 분자에 제시되었을 경우 그 세포를 감염된 세포나 암 세포로 판단해 깔끔하게 죽도록 유도합니다*. 장의 경우에는 바이러스 등에 의해 감염된 장 상피세포가 MHC 1 분자를 통해 바이러스나 병원체의 항원을 제시하면, 살해 T세포가 이를 인식해 제거할 수 있습니다.
* MHC 클래스 1에 제시되는 '세포질 유래 항원'은 세포 자신이 만든 단백질입니다. 따라서 그 단백질은 바이러스 DNA의 도입으로 세포 자신이 만들게 된 바이러스 단백질일 수 있습니다. 이러한 MHC 클래스 1은 핵을 가진 모든 세포에서 발현됩니다(적혈구에선 발현 X). 따라서 살해 T세포는 바이러스를 만들고 있는 세포를 인지하고 그 세포의 사멸을 유도할 수 있습니다. 또한, 암세포도 비정상적인 단백질을 만들고 있기에 살해T세포는 이 세포가 암세포임을 인식하고 그 세포의 사멸을 유도할 수 있죠. 반면, MHC 클래스 2는 '외래 유래 항원'을 제시하며, 외부 병원균에 대한 정보로 후천면역세포들의 활성 및 기능을 유도합니다. 이러한 MHC 클래스 2 분자는 항원제시세포(DC, B세포, 대식세포)에서만 나타납니다(물론 가슴샘에서 조력 T세포가 MHC 클래스 2 분자를 인식하도록 하는(인식하는 T세포만 살아남도록 하는) 교육을 담당하는 교사세포도 MHC 클래스 2를 발현하긴 합니다).
그렇다면 살해T세포는 어떻게 감염된 세포 혹은 암세포가 깔끔하게 죽도록 유도하는 걸까요? 그 기작은 바로 '세포 자멸사(apoptosis)'를 통해 이루어집니다. 구체적으로, 살해T세포는 문제가 생긴 세포에 퍼포린(perforin)으로 구멍을 뚫은 뒤, 그랜자임(serin protease)을 그 세포에 주입해 세포 자멸사(apoptosis)를 유도합니다. 이러한 세포자멸사는 깔끔한 죽음으로, 중성구처럼 세포 내부 물질들을 사방팔방 퍼뜨려서 염증 반응을 과도하게 일으키게 되는 문제를 일으키지 않을 수 있습니다. 그렇게 자멸사된 세포는 대식세포에 의해 청소됩니다. 이러한 깔끔하고 조용한 죽음을 유도하는 살해T세포가 활성화되려면 앞선 조력T세포(CD4+ T cell)와 마찬가지로 수지상세포(DC)가 도움을 주어야 하는데요. DC의 MHC 클래스 2 분자를 인식하는 조력T세포와 달리, 살해T세포는 DC의 MHC 클래스 1을 인식하여 활성화합니다.

여기서 '인식' 한다는 말은 한 가지 종류로 되어 있는 TCR(T cell receptor)을 세포 표면에 발현하고 있는 T 세포가 DC의 MHC 분자가 제시하는 항원에 딱 맞게 되어(급할 경우 그런대로 맞게 되어) 그 T 세포가 활성화되어 증식 및 분화하게 된다는 말입니다. 이는 사실 병원균, 바이러스 등의 항원을 인식할 수 있는 TCR을 가진 T 세포들이 우리 몸에 이미 존재하고 있음을 전제로 합니다. 이 부분이 굉장히 놀라운 면역 전략인데요. 우리 몸의 면역세포들은 소수로 존재할 뿐 우리 몸에 침입할 수 있는 모든 외부 항원들을 인식할 수 있는 TCR들을 이미 가지고 있다는 의미이기 때문입니다. 그렇다면 아직 침입하지도 않은 항원을 인식할 수 있는 T세포의 TCR은 어떻게 이미 존재할 수 있는 걸까요? 우리 세계에선 정말 다양한 구조를 가진 항원들이 많을텐데 말이죠. 그만큼 언뜻 생각하기엔 다양한 항원에 대항하는 TCR들을 만들어내기 위해선 수십 억개의 TCR 유전자를 가져야할 듯 한데, 우리의 유전자는 약 2만개 정도밖에 되지 않습니다. 그럼에도 이렇게 다양한 TCR들을 만들 수 있는 건 우리는 V(D)J recombination이라는 유전자의 변형 및 조합 과정을 통해 수십 억 종류의 TCR을 가진 T세포들을 만들어두기 때문입니다. 즉, 소수의 유전자를 조합해서 엄청난 다양성을 만들어내는 것입니다. 자세한 설명은 길어질 것 같으니 생략하도록 하겠습니다. 아래 영상을 참고하시길 바랍니다.
암튼 그렇게 수지상세포가 제시하는 항원을 인식한 살해T세포는 활성화됩니다. 그렇지만 이게 끝이 아닙니다. 살해T세포가 효과적으로 기능을 수행하기 위해서는 한번 더 활성화되어야 합니다.
살해T세포가 제대로 잠에서 깨어나려면 두번째 신호가 필요하다. 살해T세포는 매우 위험한 녀석이기 때문에 아무때나, 그저 실수로 활성화되면 안된다. 따라서 B세포처럼 완전히 활성화되려면 2단계 인증이 필요하다. 수지상세포에 의해서만 활성화된 살해T세포는 클론을 많이 만들지 못하고, 싸울수는 있지만 동작이 약간 굼뜨며 비교적 빨리 자멸사하는 경향이 있다. 두번째 활성화신호는 어디에서 올까? 조력 T세포다. 2)
앞서 잠깐 언급하긴 했지만 B 세포는 항원제시세포로서 항원을 섭취(intake)하고, 이를 MHC 클래스 2 분자에 제시하면*, 같은(혹은 유사한) 항원을 인식하는 TCR을 가진 T세포에 의해 활성화되어 친화도 성숙, 형질 전환 등을 통해 친화도 높은 강력한 항체들이 분비됩니다. 이처럼 살해T세포도 DC에 의해 활성화된 뒤, DC에 의해 활성화된 조력T세포가 IL-2를 분비해 살해T세포를 추가적으로 활성화하면, 완전히 활성화된 살해T세포는 빠른 속도로 증식해 수많은 자기복제클론을 만든 뒤(clonal expansion) 림프절에서 염증 부위(조직)로 이동합니다2). 염증 부위에 도착하고 나선 바이러스에 감염된 세포(혹은 암세포)나 MHC1 분자를 통해 자신이 외부 침임균임을 알리고 있는 병원균들의 죽음을 유도하죠. 물론, 장 내 병원균은 대개 장 상피세포 표면 또는 장 내강에 머무르는 경우가 많기에 이 경우 살해T세포보다는 병원균을 중화하거나 옵소닌화할 수 있는 IgA 항체, 그리고 그 병원균을 포식하는 대식세포을 통해 병원균에 대항합니다.
* 참고로 B세포는 특정 항원만을 인식할 수 있는 한 가지 종류의 BCR(B cell receptor)들을 통해 항원을 인식합니다. 이때 반드시 DC에 의해 항원을 인식하는 T세포와 달리, B세포는 DC 도움 없이 항원을 인식합니다. 그러면서도 BCR 또한 TCR처럼 V(D)J recombination을 통해 수십억개의 항원들을 인식할 수 있는 BCR들이 우리 몸 속에 이미 존재하고, 몸에 침입한 항원을 인식할 수 있는 BCR을 가진 B세포가 그 항원의 펩티드를 MHC 클래스 2 분자에 제시하면 같은(혹은 유사한) 항원을 인식하는 TCR을 가진 T세포에 의해 활성화가 될 수 있는 것입니다. 여기서 같은 뒤에 '혹은 유사한'이라고 쓴 이유는 빠른 대처가 필요한 위급 상황에서 우리의 B세포가 딱 맞는 항원을 찾으려면 시간이 많이 걸리고 그보다 그럭저럭 맞는 항원이라도 인식하여 후천 면역을 활성화함으로써 감염에 신속하게 대처하는게 더 생존에 유리하기 때문이라고 추측해볼 수 있습니다. 물론 딱 맞지 않으므로 특이성은 떨어지겠지만, BCR의 경우 조력 T세포의 도움으로 친화도 성숙을 거칠 수 있습니다. 그에 따른 부작용도 있는데요. 그럭저럭 맞는 항원을 인식하기에 '자신의 세포에서 유래한 항원(자가 항원)'과 '병원체에서 유래한 항원'이 비슷한 구조를 가지면 면역계가 자기와 타자를 구분하지 못해 자신의 세포를 공격함으로써 자가면역질환으로 이어질 위험이 존재하기도 합니다.
수지상세포는 침입균의 항원의 표본을 지금 이 순간도 끊임없이 수집하면서 후천면역세포(B세포, T세포)들을 활성화하는 역할을 합니다*. 그렇다면 수지상세포는 표본을 수집한 세균이 위험한 병원균인지, 무해한 공생균인지는 어떻게 알 수 있을까요? 위험한 병원균이면 신속하게 대처해야 하고, 무해한 공생균이면 면역관용을 베풀어야 할텐데 말이죠. 책2)에서 말하길, 답은 아무도 모르며, 분명한 건 수집한 표본이 공생균일 때 수지상세포는 국소적으로 면역계에 자신이 제시한 항원에 놀라지 말고 흥분을 가라 앉히라고 명령을 내린다"고 합니다. 그렇다면 공생균은 면역 관용(immune tolerance)을 유도하고 병원균은 빠르게 대처할 수 있도록 하는 그 메커니즘의 차이를 유도하는 요인이 무엇일지 밝혀내는게 중요할 듯 합니다(이미 밝혀졌는데 제가 모르는 걸 수도 있습니다). 무엇보다 둘 다 타자이고, 우리의 선천면역세포들은 패턴 인식 수용체(TLR)를 통해 그 타자를 인식할텐데 공생균이 침입했을 땐 면역관용을 유도하고, 병원균이 침입했을 땐 강력하게 대응하게 하는 그 요인이 도대체 뭘까요? 공생균이 SCFA 생산으로 Treg 분화를 통해 항염증 반응을 유도하기 때문에 문제없이 거주할 수 있어서 예외적으로 면역관용을 유도하는 걸까요? 장내미생물의 세계는 알면 알아갈 수록 알아갈게 더 많은 복잡한 세계인 것 같습니다. 지금 제가 제대로 적고 있는지도 잘 모르겠습니다. 암튼 그렇게 우리는 병원균의 침은 빠르게 저지하면서도 공생균의 생존은 돕고, 공생균 중에서도 장 점막을 침입한 세균은 죽이는 그런 기전으로 우리는 면역계 항상성을 유지합니다.
* 수지상세포 외에도 또 다른 선천면역세포인 자연살해세포(Natural Killer cell)도 있는데요. 자연살해세포는 자신이 문제가 있는 세포(바이러스에 감염된 세포, 암세포)임을 숨기기 위해 MHC 클래스 1 분자를 발현하지 않거나 낮게 발현하는 세포 혹은 문제가 생겨 스트레스를 많이 받은 세포를 죽입니다. 자연살해세포는 문제가 있는 세포에게서 앞선 살해T세포처럼 퍼포린과 그랜자임을 통해 깔끔하고 조용한 세포 죽음인 세포자멸사를 유도합니다. 이때 문제가 있는 세포의 MHC1 분자 인식을 함과 동시에 퍼포린과 그랜자임을 만드는 살해T세포와 달리, 자연살해세포는 퍼포린과 그랜자임을 항상 만들고 있으며 그만큼 항상 공격적인 상태입니다. 그런 덕분에 자연살해세포는 살해T세포보다 더 신속하게 위험에 대항할 수 있지만 특이성은 없기에 그 효과는 떨어집니다. 그래도 감염 2~3일 뒤 감염부위에 도착하는 자연살해세포는 우리 몸이 감염을 극복하는 데 큰 도움을 줍니다. 또한, 자연살해세포(NK Cell)에는 혈액 중 가장 풍부한 항체인 IgG(중화, 옵소닌화 등)와 결합할 수 있는 Fc 수용체(Fcγ 수용체)가 있습니다. 이 수용체를 통해 자연살해세포는 병원균이나 문제가 생긴 세포에 결합한 IgG를 인식함으로써 그들을 더욱 쉽게 제거할 수 있죠. 물론, 장과 같은 점막 조직에서 주된 역할을 하는 항체는 IgG가 아니라 점막 면역에 특화된 IgA입니다.
이렇듯 장내미생물이 숙주 면역계와 상호작용 하는 건 확실하지만, 그 둘의 상호작용이 어떻게 자가면역질환, 알레르기, 그리고 암에 영향을 미치는지에 대한 추가적인 연구들이 필요한 상황입니다. 물론 논문들을 보니 이를 밝히기 위해 최근에 정말 많은 연구들이 이루어져왔다는 걸 알 수 있었는데요. 그래도 장내미생물과 숙주 면역계의 상호작용을 이해한다는 것 자체가 까다롭기에, 그리고 그 상호작용이 정말 다양한 질병에 핵심적인 영향을 미칠 수 있기에, 앞으로 보다 발전된 '장내미생물과 숙주 면역계 간 상호작용 분석 연구'가 꾸준히 필요할거라고 판단됩니다. 사실 제 현재 관심 분야이기도 합니다. 특히 장내 미생물 조성을 이해함에 있어 하나의 미생물 균주의 존재 혹은 부재로 질환 발생을 판단하는 것은 그 미생물 균주가 전체 미생물 생태계에 어떤 영향을 주는지에 따라 무리가 있을 수 있기에 장 환경 맥락에서 면역세포, 상피세포, 장 점막층, 그리고 그들끼리도 상호작용하는 장내 미생물 조성을 고려해, 그들이 숙주 면역에 미치는 영향을 파악하는 전략이 필요한 상황입니다. 그러면서도 장 환경 및 장내 미생물 조성은 라이프스타일, 식단, 유전적 요인, 면역계 기능, 그리고 다른 질환들의 존재가 영향을 미칠 수 있기 때문10)에 장내미생물 조성과 질병 간의 인과성을 탐구함에 있어 교란 변수(노이즈)들을 최대한 억제하거나, 이와 같인 환자의 특징적인 요인을 고려해 질병 치료 전략을 수립하는 것이 중요한 상황입니다. 그렇다면 장내 미생물이 질병에 어떤 영향을 미치는지는 다음 장에서 정리해보도록 하겠습니다. 마치기 전에 장내 미생물 조성에 있어 항생제의 위험성을 다룬 내용을 정리해보고자 합니다.
+ 장내 미생물 조성에 있어 항생제의 위험성
항생제(antibiotics)는 인간 세포와 세균의 기능적 혹은 구조적 차이점을 활용해 세균의 단백질 합성을 억제하거나(리보솜 구성의 차이), 세균이 세포벽을 만들지 못하게 하는(인간 세포는 세포벽 만들지 X) 등 세균을 타깃으로 해 세균 감염을 치료하는 약물입니다. 그렇지만 우리 몸에 이로운 영향을 주는 장내 미생물의 대부분도 세균이죠. 따라서 항생제를 처치하게 되면, 장내 미생물 조성의 다양성이 감소하게 되면서 병원균의 침입에 취약해집니다. 건강한 상태에선 장내 공생균들이 자리를 잡음으로써 병원균이 자리잡지 못하도록 막고 있었기 때문입니다. 이외에도 공생균은 박테리오신(bacteriocin)과 같은 자체적인 항생제를 만들어 병원균을 죽이는 전략을 통해, 혹은 앞서 봤듯 B세포의 IgA 항체 분비를 유도해 병원균의 체내 침입을 막기도 하죠. 그러나, 항생제를 처치하게 되면 이러한 몸에서 이로운 영향을 주던 공생균들도 죽이게 되고 그러면서 병원균 침입에 취약해지는 것은 물론, 앞서 잠깐 언급했던 클로스티리듐이라는 기회감염균이 장 내에 주도권을 잡게 할 수 있습니다. 참고로, 클로스트리듐은 항생제에 내성을 갖는 균으로, 설사, 구토, 심하면 생명을 위협하는 만성 장염을 일으킬 수 있습니다2). 클로스트리듐 외에도 항생제를 지속적으로 복용하다보면 돌연변이를 통해 항생제에 저항력이 강한 균들이 등장하게 되고, 그들이 병원균으로써 우리의 몸에 문제를 일으킬 수 있습니다. 전 글에서 살펴봤듯 세균은 수평적 유전자 전달을 통해 항생제 내성 유전자들을 집단 전체에 쉽게 전달하여 빠른 적응을 통해 집단 전체의 생존력을 빠른 속도로 높일 수 있기 때문입니다(아래 글 참조).
[47일차] 생물정보학 입문 책 정리 ch.03-2 :: 인생의 전경, 16S rRNA 시퀀싱
안녕하세요, 오늘은 저번 글에 이어 '생물정보학 입문 책' 챕터 3 나머지 부분을 정리해보도록 하겠습니다. 전 글에서 말했듯 '수평적 유전자 전달'에 대한 내용부터 시작하겠습니다. [46일차]
tkmstudy.tistory.com
항생제 외 다른 약물들도 장내 미생물 조성을 변화시킬 수 있는데요. 대표적인 예로, 비스테로이드성 항염증제(non-steroidal anti-inflammatory drugs (NSAIDs)가 있습니다4). NSAID는 원래 체내 염증 반응을 억제하기 위해 사이클로옥시게나제(COX) 효소를 차단하여 프로스타글란딘 합성을 감소시키는 약물입니다. 그런데 프로스타글란딘은 단순히 통증이나 염증만 조절하는 것이 아니라, 위장관 점막을 보호하고 재생을 도와주는 기능도 가지고 있기에 염증을 줄이려는 목적에서 COX를 억제하면 장 점막 보호에 관여하는 프로스타글란딘까지 함께 줄어들어 점막이 손상받기 쉬운 상태가 될 수 있습니다. 결국 손상받은 장 점막은 염증 반응을 유발하고, 장내 미생물 조성의 교란을 유발할 수 있게 됩니다.
이외에도 장내 미생물은 약물의 대사, 효험, 안정성에도 영향을 미칠 수 있습니다. 구체적으로, 장내 미생물은 약물을 앞선 담즙산처럼 화학적으로 변경시켜 그것들의 생물학적 이용 가능성(bioavailability)과 활성에 영향을 가할 수 있습니다. 즉, 일부 미생물 종들의 효소적 활동이 복용한 약물들을 활성화하거나 비활성화시킬 수 있습니다4). 그 예로, 감마프로테오박테리아(Gammaproteobacteria)와 같은 특정 균주는 항암화학약물인 젬시타빈(gemcitabine)을 대사하여 암 치료의 효과성(effectiveness)를 낮춘다4)고 보고되기도 했습니다. 물론 약물과 장내미생물 사이의 상호작용도 굉장히 복잡합니다. 그 둘의 상호작용은 약물의 유형, 복용량, 치료기간, 개별 환자의 유전적 특징 등 다양한 요인에 영향을 받을 수 있기 때문이죠. 그래도 앞으로 환자의 데이터와 약물 데이터를 통합 분석해 환자의 장내미생물 조성, 환자의 유전적 특성, 약물과 장내미생물의 상호작용 등을 고려함으로서 적절한 시기에 적절한 양으로 약물을 투여하는, 그렇게 치료 효험을 극대화하는 그런 맞춤화 전략이 각광받게 되지 않을까 싶습니다. 물론, 그런 흐름에서도 환자의 개인정보 데이터를 누구인지 식별하지 못하도록 암호화하여(희귀질환 환자까지) 신뢰도 높게 보호할 수 있는 기술도 함께 발전해야 할 것입니다. 다음 글에선 장내 미생물과 질병 간의 연관성을 다루는 글로 찾아오겠습니다. 감사합니다!
- 참고자료
0) BioOne, 미생물 클러스터, URL : https://www.bioone.re.kr/conts/clustr/cs0005/info
1) 김규원, 미생물, 모든 것을 연결하는 지구의 주인, 서울대학교출판문화원, 2023.11
2) 필리프 데트머, 강병철 옮김, 면역(IMMUNE), 2021
3) 저자 ARTHUR M. LESK. 번역 이용석,강병철,김익수 외 3명, 생물정보학 입문 제2판, 월드사이언스, 2024
4) Paul JK, Azmal M, Haque ASNB, Meem M, Talukder OF, Ghosh A. Unlocking the secrets of the human gut microbiota: Comprehensive review on its role in different diseases. World J Gastroenterol 2025; 31(5): 99913
Unlocking the secrets of the human gut microbiota: Comprehensive review on its role in different diseases
Unlocking the secrets of the human gut microbiota: Comprehensive review on its role in different diseases
www.wjgnet.com
5) Alam MZ, Maslanka JR, Abt MC. Immunological consequences of microbiome-based therapeutics. Front Immunol. 2023 Jan 12;13:1046472.
6) Kyung Hee Hong, Ki-Hyo Jang, Soon Ah Kang. Effects of Dietary β-Glucan on Short Chain Fatty Acids Composition and Intestinal Environment in Rats. The Korean Journal of Food And Nutrition Vol.29 No.2 pp.162-170
7) Rowland, I., Gibson, G., Heinken, A. et al. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr 57, 1–24 (2018).
8) Zhu, B., Bai, Y., Yeo, Y.Y. et al. A multi-omics spatial framework for host-microbiome dissection within the intestinal tissue microenvironment. Nat Commun 16, 1230 (2025).
9) Staley, C., Weingarden, A.R., Khoruts, A. et al. Interaction of gut microbiota with bile acid metabolism and its influence on disease states. Appl Microbiol Biotechnol 101, 47–64 (2017).
10) Emily R Murray, Mylon Kemp, Tanya T Nguyen, The Microbiota–Gut–Brain Axis in Alzheimer’s Disease: A Review of Taxonomic Alterations and Potential Avenues for Interventions, Archives of Clinical Neuropsychology, Volume 37, Issue 3, May 2022, Pages 595–607
11) Seohyun Byun, Jusung Lee, Yoon Ha Choi, Haeun Ko, Changhon Lee, John Chulhoon Park, Seung Won Kim, Haena Lee, Amit Sharma, Kwang Soon Kim, Dipayan Rudra, Jong Kyoung Kim, Sin-Hyeog Im; Gut Microbiota Defines Functional Direction of Colonic Regulatory T Cells with Unique TCR Repertoires. J Immunol 15 September 2024; 213 (6): 886–897.
12) Iyer SS, Cheng G. Role of interleukin 10 transcriptional regulation in inflammation and autoimmune disease. Crit Rev Immunol. 2012;32(1):23-63.
13) Saleri, R., Borghetti, P., Ravanetti, F. et al. Effects of different short-chain fatty acids (SCFA) on gene expression of proteins involved in barrier function in IPEC-J2. Porc Health Manag 8, 21 (2022).
14) 조효선, 면역학 강의, KOCW, 2015년 1학기, 12.2 체액성 면역 / 13. 미생물에 대한 면역 두번째 강의, URL : http://www.kocw.net/ home/cview.do?lid=4be4cf54504abd89
15) Petrin S, Mancin M, Losasso C, Deotto S, Olsen JE, Barco L. Effect of pH and Salinity on the Ability of Salmonella Serotypes to Form Biofilm. Front Microbiol. 2022 Apr 7;13:821679. doi: 10.3389/fmicb.2022.821679



