안녕하세요, 이번에도 질병과 장내 미생물 간의 관계에 대해 다루는 글을 작성해보고자 합니다.
[49일차] 당뇨병(diabetes mellitus)과 장내미생물 : 제1형 당뇨병, 제2형 당뇨병
안녕하세요, 이번 글에선 저번 글에 이어 '질병과 장내미생물'에 대한 내용을 정리해보고자 합니다. [48일차] 개요, 장내 미생물과 숙주 면역계 간의 상호작용에 대하여 (+ 항생제의 위험성)안
tkmstudy.tistory.com
[50일차] 감염 및 염증성 질환과 장내 미생물 : Clostridioides difficile, SARS-CoV-2, IBD(Inflammatory Bowel Diseas
안녕하세요, 이번 글에선 저번 '당뇨병과 장내 미생물'에 대해 다룬 글에 이어 '감염 및 염증성 질환과 장내 미생물'에 대해 다뤄보겠습니다. [49일차] 당뇨병(diabetes mellitus)과 장내미생물 : 제
tkmstudy.tistory.com
당뇨병, 감염 및 염증성 질환에 이어 이번에는 암과 장내 미생물의 관계에 대해 다뤄보고자 하는데요. 우선 '암(cancer)'이 무엇인지부터 짚고 넘어가겠습니다.

암(cancer)의 사전적 정의는 '사멸해야 할 비정상 세포들이 과다 증식하여 주위 조직 및 장기에 침입하면서 종괴를 형성해 기존의 구조를 파괴하거나 변형시키는 상태1)'를 말합니다. 물론 과다 증식하는 세포 집단이 곧 암은 아닙니다. 과다 증식하면서도 주변 조직을 침범하는 '전이(metastasis)'를 일으키지 않는다면, 그것은 암세포가 아닌 단순한 '종양(tumor)' 즉, 양성 종양에 해당됩니다. 양성 종양은 보통 생명에 큰 위협이 되지 않으며 저절로 없어질 수도 있고, 수술을 통해 제거하면 재발이 거의 나타나지 않습니다2). 그렇지만 종양이 주변 조직으로 전이될 수 있는 능력을 갖추게 되면 '악성(maligant) 종양' 즉, 암이 됩니다. 이러한 악성 종양은 수술로 제거해도 재발이 가능하며 우리의 생명을 위협할 수도 있습니다. 2000년에 '셀(Cell)'에 개재된 논문(약 4만4천번 인용된 전설적인 논문)에서는 암세포의 6가지 속성을 다음과 같이 묘사했다3)고 합니다.
암은 무한정 분열한다(Limitless replicative potential). 암은 호르몬 같은 외부 요인의 지시나 영향을 받지 않은 채 증식한다(Self-sufficiency in growth signals). 암은 혈관 신생을 동반하는데 그 말은 암이 몸을 속여서 혈액을 계속 공급하도록 만든다는 뜻이다(Sustained angiogenesis). 암은 성장을 멈추라는 모든 신호를 무시한다(Insenstiivity to anti-growth signals). 암은 세포자멸사 즉, 예정된 세포 죽음을 거부한다(Evading apoptosis). 암은 전이한다(Tissue invasion & metastasis). 즉, 몸의 다른 부위로 퍼진다. 3)
The hallmarks of cancer - PubMed
The hallmarks of cancer
pubmed.ncbi.nlm.nih.gov
결국 암은 타자가 아닌 자신의 세포가 자신의 통제를 받지 않고 제멋대로 자라나 무한히 증식하는 상태입니다. 무한히 증식한다고 해서 개별 세포가 영원히 산다는 말은 아닙니다. 암에 대해 다룬 책5)에서는 다음과 같이 설명합니다. "암세포는 죽지 않는다는 것은 거짓 명제다. 암세포는 많이 태어나고 많이 죽는다. 변화하는 환경에 가장 적합한 놈이 살아서 악성으로 끈질기게 나쁜 짓을 하고 다닌다고 보면 된다. 염색체의 돌연변이가 그 이면에 있고, 끝없이 분열하는 세포 분열이 그 마당이다."
이러한 암은 크게 '고형암(Solid Tumors)'과 '혈액암(Hematologic Malignancies)'으로 구분됩니다. 고형암은 허파나 근육, 뇌, 뼈, 생식기관 등 고체로 된 조직에서 암세포가 자라나기 시작하면서 덩어리를 형성하는 암 입니다. 고형암을 구성하는 암세포들은 빠르게 증식하는 만큼 영양소와 자원도 많이 필요로 하기에 이를 보충해 줄 수 있는 혈관을 많이 만들게 됩니다*. 그리고 암세포는 전이가 가능한 만큼 혈관을 뚫고 혈액으로 들어가 다른 기관에 안착하기도 합니다. 문제는 그곳에서도 암세포들은 빠르게 성장하며 '종양'을 형성하고 그렇게 신체 부위로 가야 할 영양소와 자원들을 독점하게 됩니다. 결국, 우리 몸 곳곳에서 열심히 기능해야 할 건강한 세포들은 그들의 생존에 필요한 영양소와 자원을 주변의 암세포에 의해 빼앗기게 되어 굶주리게 되고 몸은 정상적인 기능을 하지 못하게 됩니다. 다른 유형인 혈액암(ex. 백혈병)은 종종 골수에서 생기는 혈액세포에서 발생하는 암으로, 이로 인해 백혈구와 적혈구, 혈소판의 생성이 억제 됩니다. 책4)에서는 다음과 같이 설명합니다.
* 암의 영어 표현인 'cancer'는 라틴어로 ‘게’를 의미합니다. 암 종양이 혈관 신생을 통해 주변 조직으로 뻗어나가는 모습은 게의 다리 형태와 유사하여 암을 'cancer'라고 부르게 되었다는 속설이 전해집니다5).
허파나 근육, 뇌, 뼈, 생식기관 등 고체로 된 조직에서 암세포가 자라기 시작하면 종양을 형성한다. 세포들이 조그만 부락으로 모여 살기 시작해 종국에는 거대한 도시를 이루고, 그것으로도 모자라 몸이라는 대륙을 가로질러 뻗어 나간다.. 덩어리를 형성하는 고형 암과 달리 혈액, 골수, 림프, 림프계를 침범하는 암은 '액체'다. 이런 암은 종종 골수에서 생기며 혈관과 림프관 등 우리 몸의 슈퍼 하이웨이를 따라 걷잡을 수 없이 퍼진다. 혈관과 림프관 속에 아무 쓸모 없는 암세포가 가득차는 것이다. 4)
결국 암은 조직에서 고형암으로 형성될 수 있는 것은 물론, 혈액에서도 혈액암으로 형성될 수 있습니다. 그말은 즉슨 몸 속 모든 조직과 세포에서 암이 생길 수 있다는 뜻입니다. 무엇보다 몸은 다양한 세포로 이루어져 있는 만큼 암 역시 다양한 종류가 존재합니다(약 200종류). 즉, 암은 단일한 질병이 아닌 원인과 예후가 서로 다른 질병들의 집합으로, 치료에 있어서 어려움도 각기 다릅니다. 물론 암의 대부분은 고형암으로 알려져 있는데요. 구체적으로, 암의 80%는 피부와 장기 표면을 덮고 있는 상피세포에서 생기며, 이러한 암을 '암종(carcinoma)'이라고 합니다3). 이전에 '간세포 암종(hepatocellular carcinoma)'을 다룬 논문을 정리했던 기억이 납니다.
[42일차] 논문 리뷰 연습 04 :: PKM2 Drives Hepatocellular Carcinoma Progression by Inducing Immunosuppressive Microenviro
안녕하세요, 이번엔 2023년 말에 전공수업에서 공부하고 리뷰 발표했던 논문을 다시 한번 정리해보려고 합니다. 논문 제목은 'PKM2 Drives Hepatocellular Carcinoma Progression by Inducing Immunosuppressive Microe
tkmstudy.tistory.com
그렇다면 '암(cancer)'은 왜 발생하는걸까요? 다시 말해, 우리 몸의 정상 세포가 어떤 이유로 암세포가 되는 걸까요? 암이 생기는 이유에 대해 서울대 이현숙 교수께서는 책에서 "DNA를 담고 있는 유전체가 불안정해졌기 때문"이라고 설명합니다5). 즉, 암은 '유전체의 불안정성으로 인한 질병'이라고 합니다.

물론, 우리의 유전체 즉, DNA는 끊임없이 손상되고 있으며, 따라서 돌연변이는 자연적으로 나타나게 됩니다(평균 세포의 유전 부호는 하루에 수 만번 손상을 겪는다4)고 합니다). 그럼에도 정상적인 경우엔 거의 문제를 일으키지 않거나 즉시 복구되어 우리에게 큰 영향을 미치진 않습니다. 허나 돌연변이 복구 기작까지 손상되었을 때, 때마침 그 돌연변이가 무분별한 증식을 유도하는 유전자에서 발생한지라 통제를 벗어나 증식하기 시작했을때, 그렇게 문제가 생겼음에도 세포가 스스로 목숨을 끊는 능력을 잃어버리게 되었을 때 그 세포는 몸을 위협하는 암세포가 됩니다. 차근차근 설명해보겠습니다. 먼저 자연적으로 혹은 특정 요인에 의해 세포의 성장과 증식을 모니터링하는 종양유전자*에 돌연변이가 생깁니다. 해당 유전자는 우리가 배아 때 활발한 증식을 위해 필요로 했지만(1개의 세포가 몇 개월 만에 몇 조개의 세포로 불어나야 하니까) 성인이 되면 활성이 꺼져야 하는 유전자입니다. 두번째로, 종양유전자의 돌연변이를 수리(복구)하는 유전자 즉, 종양억제유전자에서도 돌연변이가 발생합니다. 다시 말해, 돌연변이 복구 기작에도 돌연변이가 생겨 DNA 손상 복구가 이루어질 수 없는 것이죠.
* 보다 정확하게 설명하자면, 종양유전자(oncogene)는 변이가 일어나지 않은 상태의 원종양유전자(pro-oncogene)5)라고 합니다.
이것이 끝이 아닙니다. 세포는 자신의 종양유전자와 종양억제유전자에 돌연변이가 생겨 유전자가 위험 수준으로 손상 되었다는 걸 인지하면 세포자멸사(apoptosis)를 통해 스스로 깔끔하게 사멸합니다. 그러나, 이때 어떤 이유로든지 간에 세포자멸사를 유도하는 유전자까지 돌연변이가 일어나 문제가 생긴 세포가 죽지 않게 되면 그 세포는 암세포가 됩니다4). 사실 이는 단순한 설명입니다. 암세포 발생은 다양한 원인에 의해 나타나며, 보통 이 외에도 추가 요인에 의해 체계마다 많은 유전자가 나쁜 방향으로 돌연변이를 일으켜야 한다4)고 알려져 있습니다(물론 종양유전자, 종양억제유전자, 그리고 세포자멸사를 유도하는 유전자의 돌연변이는 암세포 발생의 가장 기본적인 특징4)이라고 하네요).
이러한 돌연변이(mutation)는 발암물질에 의해서 발생될 수도 있지만, 자연적으로도 끊임없이 발생될 수 있고 그중 일부의 돌연변이는 복구 기작을 통해 복구되지 못할 가능성이 있습니다. 인간도 그렇듯 세포의 기능도 완벽하진 않기 때문입니다. 결국 복구에 실패한 DNA 손상이 시간이 흘러 누적되면 자연적으로 암세포가 발생할 수 있습니다. 그만큼 암은 '노화'와 연관이 있으며, 오래 살수록 암에 걸릴 확률은 높아지게 됩니다. 다시 말해, 암의 가장 대표적인 원인은 오래 사는 것입니다.
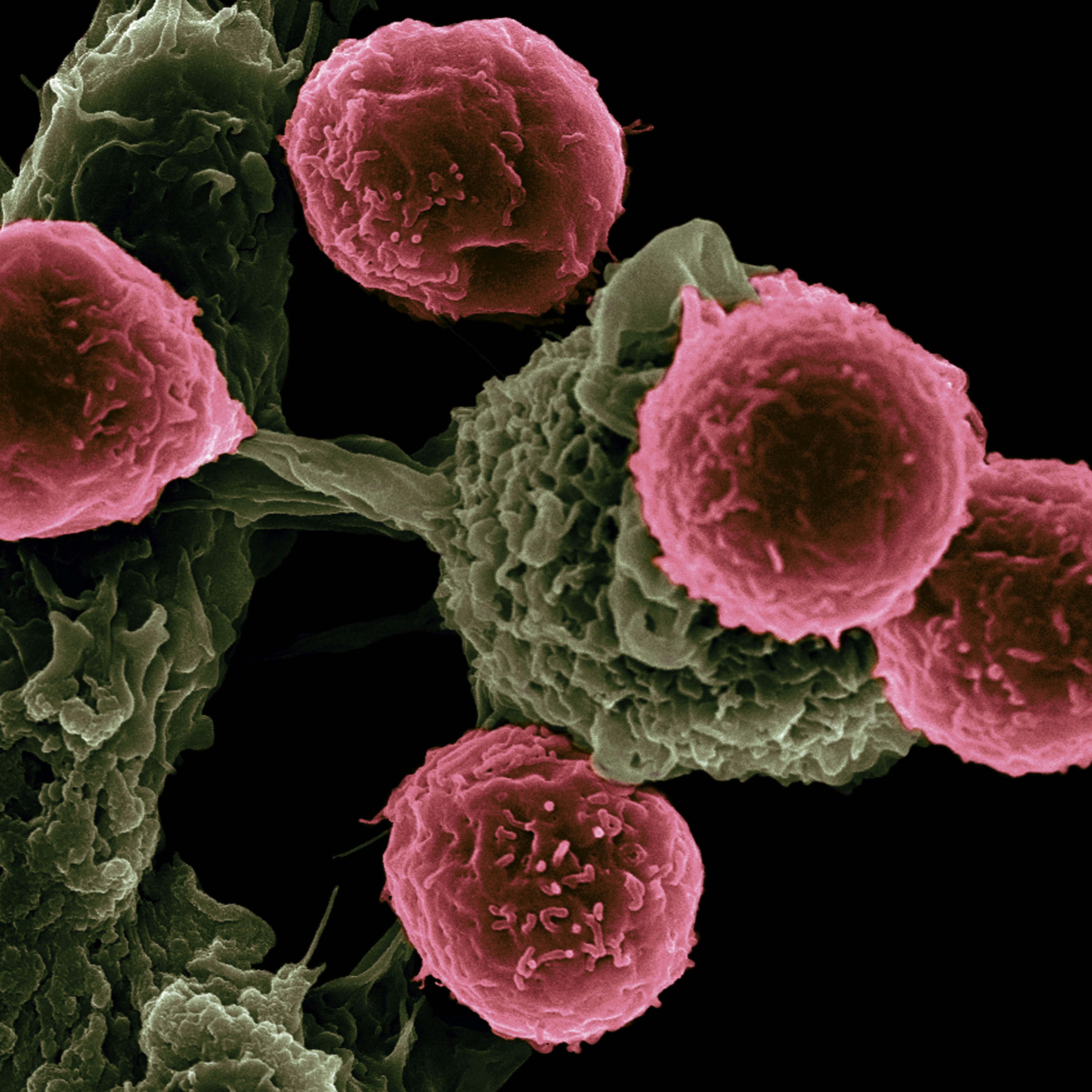
물론 우리의 면역계는 암세포들을 가만히 두지 않습니다. 다시 말해, 우리의 면역세포들은 암세포들을 찾아내 제거합니다. 암세포들을 찾아낼 수 있는 건 암세포가 필연적으로 유전적 오염을 지니고 있으며, 비정상적인 단백질을 만들어내기 때문입니다. 암세포는 결국 자신의 정체성(identitiy)을 나타내는 MHC 클래스 1 분자에 비정상적인 펩티드를 제시하게 되고, 이를 인식한 세포독성 T세포(CD8+ T cell)는 퍼포린과 그랜자임을 통해 암세포에 구멍을 뚫어 세포자멸사의 신호를 전달합니다. 그렇게 죽은 암세포의 사체들은 대식세포(Macrophage)가 처리합니다.
이외에도 MHC 클래스 1 분자를 통해 자신의 정체성을 나타내지 않거나 세포막에 수많은 스트레스 분자를 나타내는 세포는 자연살해세포(Natural Killer Cell)가 퍼포린과 그랜자임을 통해 암세포의 세포자멸사를 유도합니다4). 그렇게 죽은 암세포들은 대식세포가 처리합니다. 사실 세포독성 T세포는 자연살해세포와 달리 후천면역세포입니다. 따라서 시간의 흐름을 보면 선천면역세포인 자연살해세포가 먼저 암세포를 인식한 뒤 사이토카인 등으로 수지상세포를 활성화하고, 그렇게 비상모드로 들어간 수지상세포는 죽은 암세포들의 표본을 림프절에 있는 T세포에게 전달해 조력T세포와 세포독성T세포를 활성화합니다. 그리고 활성화된 일부의 조력T세포와 세포독성T세포는 암이 생긴 부위로 이동하게 되고, 조력T세포는 죽은 암세포를 처리하는 대식세포 활성화를 돕고 세포독성T세포는 암세포를 인식해 세포자멸사를 유도합니다. 이러한 면역 메커니즘으로 우리는 암세포들의 세포자멸사를 유도하며 암을 몰아낼 수 있습니다. 문제는 암세포는 끊임없이 증식하며 끊임없이 돌연변이를 만들어낼 수 있다는 것입니다. 다시 말해, 암세포는 환경의 변화에 따라 그에 적합한 암세포의 형질들을 끊임없이 만들어낼 수 있으며*, 그 형질을 가진 세포가 살아남아 증식을 이어갈 수 있다는 것입니다. 다시말해, 암세포는 면역세포에 의해 순순히 사멸할 정도로 단순하지 않습니다.
* 물론 돌연변이에는 방향성이 없기에 생존에 적합하지 않은 암세포 형질도 만들어질 수 있습니다. 허나 수많은 돌연변이를 만들어내게 되면 그중 유리한 형질을 가진 암세포가 살아남아 무분별한 증식을 이어갈 수 있게 됩니다. 마치 B세포가 조력T세포에 의해 체세포 돌연변이(hypermutation)가 나타나고 그중 조력T세포의 활성 신호를 다시 받을 수 있는, 그래서 생존에 이어갈 수 있는 항원 친화도가 높은 BCR을 가진 B세포가 선택되는 과정이 떠오릅니다. 물론 하나의 형태로 정해져 있는 항원과 달리, 우리 몸은 지속적으로 변화하고, 변화하는 환경에서 생존에 유리한 형질을 지속적으로 달라질 수 있습니다. 그렇게 달라지는 환경에 적응할 수 있는 형질을 가진 암세포들이 끊임없이 선택되며 암의 무분별한 증식은 지속되게 됩니다(물론 암이 유발될 때 어떤 유전자에서 돌연변이가 생겼는지 정리해본 결과 매우 많은 유전자가 있는 것 같지만 그 속의 질서를 보면 어떤 분야(ex. 세포 주기, 세포의 신호 전달, 유전자 전사)들이 존재했다5)고 합니다).
암세포는 면역계로부터 자신을 보호하기 위한 전략들을 취합니다. 한 예로, 암세포는 세포독성 T세포와 자연살해세포가 자신을 제거하지 못하도록 그 세포들의 표면에 있는 '억제 수용체(PD-1, CTLA4)'와 결합해 면역억제반응을 활성화시킵니다. 당연히 면역반응이 이루어지지 못하면 면역세포들은 암세포를 죽이지 못하게 되죠. 그렇다면 면역세포에는 왜 면역 억제 장치가 있는 걸까요? 그 이유는 바로 과도한 면역반응은 건강한 주변의 세포들까지 손상시켜 우리 몸의 기능에 악영향을 미칠 수 있기 때문입니다. 결국 적당한 수준의 면역 반응이 우리 몸의 건강을 유지 및 회복하는데 도움이 된다고 볼 수 있겠습니다.
그러나 암세포는 우리 몸의 건강 즉, 생존에 크게 관심 없습니다. 암세포들은 자신들의 생존에만 신경을 씁니다. 그렇게 암세포들은 면역세포들의 억제 수용체를 활성화하여 생존을 이어가고, 면역세포가 통과하기 어려운 자기들만의 세상인 '종양미세환경(Tumor MicroEnvironment, TME)'을 건설합니다. 몸 안에서 자기들만의 세상을 건설하며 걷잡을 수 없게 커진 암세포 집단은 결국 전이를 일으켜 다른 조직이나 기관에 뿌리를 내리고 다시 끊임없이 성장하게 되어 또다른 TME를 건설하고, 우리 몸의 기능은 하나 둘씩 망가지기 시작합니다.

암은 염증을 동반할 수도 있고, 동반하지 않을 수도 있습니다. 암은 '타자'가 아닌 문제가 생긴 '자신'이기 때문입니다. 암이 염증을 동반하지 않을 경우엔 우리 몸은 암을 알아차리지 못할 때가 종종 있다3)고 합니다. 그러다 종양이 너무 커졌을 때 우리는 무엇인가 잘못되었다는 걸 깨닫게 되죠. 물론 암은 염증을 동반하기도 하며 염증이 암의 원인이 되기도 합니다. 예로, 위암(stomatch cancer)의 경우 위염이 계속해서 발생하는 사람에게서 나타날 확률이 훨씬 높다5)고 알려져 있는데요. 만성 염증은 활성 산소를 생성하는 것은 물론 염증상 사이토카인의 과발현을 통해 DNA 복제기에 돌연변이를 유도할 수 있기 때문입니다*. 앞서 말했듯 DNA가 불안정해지면 암이 발생할 수 있습니다. 심지어 만성염증은 면역계가 암세포를 회피하게 유도하여 암을 발생시킬 수도 있습니다5). 만성 염증이 지속되면 면역계가 반복되는 자극에 지쳐 조절 기능이 약화되어 암세포와 같은 비정상적인 세포를 효과적으로 제거하지 못할 수 있기 때문입니다. 암은 내부에서 외부 침입 없이 이루어질 수도 있지만, 바이러스와 세균이 암을 일으키면서 동시에 염증 반응을 일으킬 수도 있습니다. 그말은 즉슨 장내 미생물 조성 또한 암 발생, 그리고 항암 면역에 영향을 미칠 수 있다는 것입니다. 그 영향은 직접적일 수도 있고 간접적일 수도 있습니다. 다시 말해, 바이러스와 세균이 감염을 통해 암 발생에 영향을 미칠 수도 있고, 장내 미생물이 면역 반응을 조정하여 발암과 항암에 영향을 줄 수도 있습니다.
* 염증성 사이토카인의 과발현은 활성산소(ROS)의 증대 및 염증 신호 경로 활성화로 인한 DNA 수리기작 부담을 유도해 DNA 손상을 야기할 수 있습니다. 그렇게 DNA 복제기에 돌연변이를 유도할 수 있는 것이죠. 이러한 염증 반응에 의한 DNA 손상은 다시 염증 반응을 활성화시킬 수 있습니다. 이 과정엔 텔로미어 손상 또한 포함된다5)고 하는데요. 여기서 텔로미어(telomere)는 세포의 수명을 결정짓는 DNA 말단 조각으로, 나이가 들수록 즉, 세포가 분열할수록 텔로미어의 길이는 짧아지고, 결국 일정수준까지 짧아지게 되면(보통 텔로미어의 t고리가 형성되지 않을 정도까지) 세포는 DNA가 손상되었다고 인식해 세포주기 체크포인트가 발동하여 분열을 멈추게 됩니다. 그렇게 분열을 멈추게 되면 세포 노화(cellular senescence)가 발생합니다. 세포 노화는 세포 분열이 이루어지지 않는 것은, 물론 세포의 대사도 원활하지 않고 에너지도 조금만 만들어내는 현상5)입니다. 이렇게 노화된 세포( senescent cell)는 SASP(Senescence-Associated Secretory Phenotype)를 형성합니다. SASP에는 IL-6과 같은 염증성 사이토카인이 포함된다고 하는데요. 이들은 추가적인 염증 반응을 유발해 DNA 손상을 가중시킵니다6).

한 예로, 푸소박테리움 뉴클레아톰(Fusobacterium nucleatum)은 대장 상피세포, 면역세포 등과 상호작용하여 장 점막에 염증을 발생시키는 것은 물론 면역 회피를 유도해 종양 성장을 촉진함으로써 대장암(colorectal cancer)에 기여한다고 합니다. 구체적으로, 푸소박테리움 뉴클레아톰은 대장 상피세포의 염증성 사이토카인 분비를 증가시켜 장 상피세포 간 치밀 연접(tight junctions)을 파괴하는 것은 물론*, 면역세포 표면의 특정 수용체인 TIGIT를 인식하여 자연살해세포와 T세포의 활성을 억제한다8)고 알려져 있습니다. 그 와중에 푸소박테리움 뉴클레아톰은 다수의 종양유전자(oncogenes)의 전사를 촉진하는 단백질인 베타-카테닌(beta-catenin)을 활성화한다7)고 하며, 그렇게 발암(carcinogenesis)을 촉진할 수 있습니다. 다른 장내 미생물인 헬리코박터 파일로리(Helicobacter pylori, 위나선균)는 세포독소(cytotoxin)를 생산하고, 그 세포 독소들이 혈액을 타고 위에 전달되면 위벽세포들(stomach lining cells)에 손상을 가해 만성염증을 유도하는 것은 물론, 위암(gastric cancer)을 증가시킨다7)고 합니다.
* 장 상피세포이 염증성 사이토카인의 신호를 받으면 NF-kB와 같은 염증신호경로가 활성화됩니다. 이러한 염증신호경로는 면역세포와 병원균의 마주침을 증가시키기 위해 상피세포 간 연결인 치밀 연접을 느슨하게 합니다. 구체적으로, 치밀 연접의 내재화를 촉진해 분해를 유도합니다. 문제는 치밀 연접을 느슨하게 하면서도 면역세포의 기능을 억제하면 외부 침입균들은 체내에 침입해 몸 곳곳을 누비며 암과 같은 신체 기능 손상을 야기할 수있다는 것이죠. 위에서 말했듯, 푸소박테리움 뉴클레아톰은 꺼져있던 종양유전자의 스위치를 'ON'시킵니다.
장내 미생물이 호르몬 레벨에 영향을 미쳐서 발암을 촉진할 수도 있습니다. 대표적인 예로, 장내 미생물은 에스트로겐 레벨(estrogen)과 유방 조직으로 면역세포 침투를 조정하여 유방암 위험을 높일 수 있다7)고 합니다. 참고로, 에스트로겐은 유방암 유발 원인의 80~90% 정도를 차지하는 여성 호르몬으로, 유방 세포의 성장과 분열을 촉진시켜 유방암을 위험을 높일 수 있다10)고 알려져 있습니다. 물론 장내미생물 조성이 에스트로겐 대사에 미치는 영향은 매우 복합적이라 단순하게 판단할 순 없습니다. 허나 장내 미생물이 체내 에스트로겐 농도를 높이는데 역할을 할 수 있는 베타 글루쿠로니다제(β‑glucuronidase)를 발현한다는 점* 에서 장내 미생물이 유방암 위험을 높이는데 영향을 미칠 수 있습니다. 따라서 장내 미생물이 유방암 발병에 실제로 영향을 미치는지 추가적인 연구가 필요한 상황입니다.
*보통 간에서 에스트로겐이 결합형(conjugated form)으로 변환된 뒤 담즙을 통해 장으로 배출됩니다. 그러나, 장내에 존재하는 특정 미생물이 베타 글루쿠로니다제를 통해 결합형 에스트로겐을 탈결합(deconjugation)시킬 수 있습니다. 그렇게 탈결합된 에스트로겐은 다시 혈류로 재흡수되어 체내 에스트로겐 농도를 높이게 됩니다. 이러한 과정을 '장간 순환(enterhepatic circulation)'이라고 합니다(츨처 : 챗GPT, 오류 가능성 O).
장내미생물 조성은 발암은 물론, 항암에도 영향을 미칠 수 있습니다. 예로, 비피도박테리움(Bifidobacterium longum, Bifidobacterium breve)과 같은 유익균은 수지상세포(DC)의 기능을 높여 종양 부위로 세포독성 T세포의 침투를 증가시키는 것은 물론*, 비피도박테리아가 만드는 SCFA와 같은 대사산물은 암 세포에 '세포자멸사(apoptosis)'를 유도하여 항암 효과를 보이는 것으로 나타났다9)고 합니다. 결국 특정 장내 미생물 균주가 종양 발생을 촉진하거나 항암 효과를 보일 수 있는 만큼 앞으로 머지 않음 미래에 장내미생물 프로파일 변화를 암의 바이오 마커로 활용하거나 치료반응 예측에 이용할 수 있을 것으로 전망됩니다.
* 비피도 박테리움은 수지상세포에 존재하는 TLR 등 패턴인식수용체(PRRs)를 자극하여 수지상세포(DC)의 성숙(DC는 말초조직에서 항원을 인식하고 염증성 자극을 받을 때 1~2일 안에 성숙)과 항원제시능력을 향상시킵니다(성숙해야 높은 MHC 클래스 2 발현 + IL-12를 통해 Naive T 세포 효과적으로 활성화). 이렇게 활성화된 DC는 공동자극 분자와 염증성 사이토카인, 케모카인을 분비합니다. 그리고 이 과정은 세포독성T세포의 활성화(IL-12의 도움)와 종양 부위로의 효과적인 유입을 도와 항암 면역을 강화합니다(챗GPT 참조).
심지어 장내미생물은 항암 치료의 효험을 높이는데도 활용될 가능성이 있습니다. 2021년 발표된 임상 연구12)에서는 면역관문억제제인 anti-PD-1 therapy에 반응하지 않던 진행형 흑색종(advanced melanoma) 환자들을 대상으로 해당 치료에 반응을 보인 공여자의 장내미생물 이식(FMT)을 실시하였는데요. 그 결과 면역치료에 잘 반응하지 않던 환자의 면역치료 반응을 유도하는데 성공하였다12)고 합니다. 구체적으로, FMT 실시 후에 세포독성T세포(CD8+ T cell)의 활성이 증가한 것은 물론, 흑색종 환자의 면역억제에 관여하는 골수성 세포(IL-8-expressing myeloid cells)의 빈도가 감소함을 확인하였다고 합니다. 이는 약물에 잘 반응하는 특정 장내미생물군을 환자의 결장(colon)에 도입함으로써 약물 반응을 통한 항암 면역반응의 효험을 개선할 수 있음을 증명한 연구라고 볼 수 있겠습니다. 본 연구의 공동 연구자(co-leader)안 Giorgio Trinchieri는 다음과 같이 말했습니다.
"Our study is one of the first to demonstrate in patients that altering the composition of the gut microbiome can improve the response to immunotherapy. The data provide proof of concept that the gut microbiome can be a therapeutic target in cancer." 12)
본 연구가 발표된 이후로 어떤 장내 미생물이 이러한 면역 강화 효과를 내는지 구체적인 기전 규명 연구가 활발히 진행되고 있다12)고 하는데요. 무엇보다 이러한 FMT(분변 미생물 이식)의 효과를 극대화 하기 위해선 '최적 공여자 선정', '이식 미생물군의 표준화' 등이 필요하고, 그러면서도 부작용에 따른 악영향은 당연히 막아야 할 것입니다. 그만큼 앞으로 장내미생물 기반 치료제 개발 및 상용화에 있어 정부와 산업계의 긴밀한 협력이 필요하지 않을까 싶습니다. 그리고 학계는 '암과 장내미생물의 관계'에 있어 진리를 끊임없이 찾아나가야 하겠죠. 암을 연구해오고 있는 이현숙 교수께서 집필한 책5)에서는 다음과 같이 말합니다. "암이 왜 탄생하는지, 그 아래에 어떤 법칙과 질서가 있을거라고 생각하고, 그것을 밝히는 것이 과학이다." 무엇보다 암 연구는 암이 우리 인류의 생존을 위협하기 때문에 꼭 필요합니다.
최고의 과학책이라 뽑히는 'The Body'의 저자 '빌 브라이슨'이라 말하길, 많은 연구자들의 꿈은 암이 초기 단계일 때 혈액, 소변, 침 등의 미세한 화학적 변화를 통해 그 사실을 알아내는 것3)이라고 합니다. 그렇게 하면 암 치료가 더욱 쉽기 때문인데요. 문제는 암을 일찍 찾아낼 때 그 암이 악성인지 양성인지 알기 어렵다는 것입니다. 따라서 현재는 암이 생기지 않게 예방하기 보다는 생긴 암을 치료하는 쪽에 훨씬 더 초점을 맞추고 있는 실정이라고 하죠*. 사실 우리는 문제가 닥치기 전엔 그 문제의 심각성을 잘 인식하지 못하기도 합니다. 그러나 암이 말기로 가면 더이상 의료의 손길이 닿을 수 없을지 모릅니다. 따라서 앞으로 암의 초기 단계를 신뢰도 높게 진단할 수 있도록 다양한 근거들을 통합적으로 활용할 수 있어야 할 것이고, 그에 장내 미생물 조성도 역할을 할 수 있지 않을까 싶습니다. 앞서 말했듯 장내미생물은 발암은 물론, 항암에도 영향을 미칠 수 있기 때문입니다. 물론, 장내미생물과 암 간의 관계는 굉장히 복합적으로 작용하는 만큼 단순하게 장내미생물 존재 유무로 암을 진단하긴 어렵겠지만, 장내 미생물이 숙주의 면역계에 어떤 영향을 미치는지, 혹은 면역계로부터 장내 미생물이 어떤 영향을 받게 되는지 다각적인 측면에서 신뢰도 높게 파악할 수 있게 된다면, 암 진단 및 예방에 있어 장내 미생물 프로파일 변화를 파악하는게 질병 진단, 예방, 치료, 예후 개선 등에 도움이 되지 않을까 싶습니다. 그러한 일환으로 차후 질병 유무 혹은 중증도 증가에 따른 장내미생물 프로파일 변화를 파악하는 생물정보학 기술들을 정리할 예정입니다. 그럼 이것으로 '암과 장내미생물'에 대해 다룬 글을 마치도록 하고, 다음 글에서는 자가면역질환과 장내미생물의 관계에 대해 다뤄보도록 하겠습니다. 감사합니다!
* 빌브라이슨이 2019년에 집필한 책 '바디'3)에서 말하길, "전 세계의 암 연구비 중에서 겨우 2~3퍼센트만이 예방 분야에 쓰인다는 추정값이 나와있다"고 합니다.

- 참고자료
1) 암, 서울대학교병원 의학정보, NAVER 지식백과, URL : https://terms.naver.com/entry.naver?docId=927325&cid=51007&categor yId=51007
2) 국가암정보센터, 양성종양과 악성종양, URL : https://www.cancer.go.kr/lay1/S1T273C275/contents.do
3) 빌브라이슨 저자, 이한음 옮김, 바디(The Body), 까치, 2020
4) 필리프 데트머, 강병철 옮김, 면역(IMMUNE), 2021
5) 이현숙, 왜 늙을까, 왜 병들까, 왜 죽을까, 21세기 북스, 2024
6) 정민준 기자, "노화세포 특성 발견…노화방지 연구 가속도 붙나", 청년의사, 2023, URL : https://www.docdocdoc.co.kr/news/articleV iew.html?idxno=3003210
7) Paul JK, Azmal M, Haque ASNB, Meem M, Talukder OF, Ghosh A. Unlocking the secrets of the human gut microbiota: Comprehensive review on its role in different diseases. World J Gastroenterol 2025; 31(5): 99913
8) Borowsky J, Haruki K, Lau MC, Dias Costa A, Väyrynen JP, Ugai T, Arima K, da Silva A, Felt KD, Zhao M, Gurjao C, Twombly TS, Fujiyoshi K, Väyrynen SA, Hamada T, Mima K, Bullman S, Harrison TA, Phipps AI, Peters U, Ng K, Meyerhardt JA, Song M, Giovannucci EL, Wu K, Zhang X, Freeman GJ, Huttenhower C, Garrett WS, Chan AT, Leggett BA, Whitehall VLJ, Walker N, Brown I, Bettington M, Nishihara R, Fuchs CS, Lennerz JK, Giannakis M, Nowak JA, Ogino S. Association of Fusobacterium nucleatum with Specific T-cell Subsets in the Colorectal Carcinoma Microenvironment. Clin Cancer Res. 2021 May 15;27(10):2816-2826.
9) Choden T, Cohen NA. The gut microbiome and the immune system. Explor Med. 2022;3:219–33.
10) 서울대학교 의과대학 국민건강지식센터, "유방암 90% 과한 여성호르몬 때문… 임신 늦추지 말고 지방 섭취 줄여야", 2015, URL : https://hqcenter.snu.ac.kr/archives/31070
11) Diwakar Davar et al. ,Fecal microbiota transplant overcomes resistance to anti–PD-1 therapy in melanoma patients. Science. 371,595-602(2021).
12) NIH > NATIONAL CANCER INSTITUE, "Fecal microbiota transplants help patients with advanced melanoma respond to immunotherapy", 2021, URL : https://www.cancer.gov/news-events/press-releases/2021/fecal-transplants-cancer-immunothe rapy#:~:text=More%20research%20is%20needed%2C%20Dr,investigate%20the%20biological%20mechanisms%20involved%EF%BB%BF



